Carboxihemoglobina: características y efectos
La carboxihemoglobina es la hemoglobina unida al monóxido de carbono (CO). La hemoglobina es la proteína que transporta el oxígeno a través de la sangre en los seres humanos y en muchos otros vertebrados.
Para transportar el oxígeno, la hemoglobina debe unirse a este. Max Perutz, un químico y premio Nobel nacido en Viena en 1914 y muerto en Cambridge en el año 2002, denominó “inmoral” al comportamiento ligador de oxígeno de la hemoglobina.
Imagine dos moléculas de hemoglobina capaces de unirse cada una a cuatro moléculas de oxígeno. Una tiene ya tres moléculas de oxígeno y la otra ninguna. Si aparece otra molécula de oxígeno la pregunta es la siguiente: ¿se une a la “rica” que ya tiene tres, o a la “pobre” que no tiene ninguna? La probabilidad es 100 a 1 de que se dirija a la molécula rica.
Imagine ahora otras dos moléculas de hemoglobina. Una tiene 4 moléculas de oxígeno (está saturada) y la otra solo tiene una. ¿Cuál de las moléculas es más probable que ceda el oxígeno a los tejidos, la rica o la pobre? La más pobre entregará con más facilidad el oxígeno que la rica.
El reparto del oxígeno en la molécula de hemoglobina puede verse como la parábola bíblica: “…al que tiene, a ese se le dará y al que no tiene, incluso lo que tiene se le quitará…” (Mt, 13:12). Desde el punto de vista fisiológico este comportamiento “inmoral” de la molécula de hemoglobina está lleno de significado, puesto contribuye al aporte de oxígeno a los tejidos.
El monóxido de carbono, sin embargo, sea cual sea el número de átomos de oxígeno unidos a una molécula de hemoglobina, “arrasa” con todos. Es decir, en presencia de abundante CO, todo el oxígeno unido a la hemoglobina es reemplazado por CO.
Índice del artículo
Para hablar de la carboxihemoglobina, que no es más que un estado de la hemoglobina asociado con monóxido de carbono, es necesario primero referirse a la hemoglobina en términos generales.
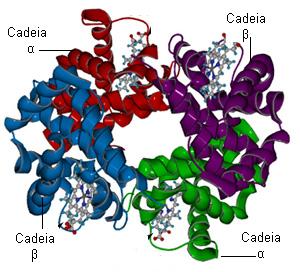
La hemoglobina es una proteína compuesta de cuatro subunidades formadas cada una por una cadena polipeptídica conocida como globina y un grupo de naturaleza no proteica (grupo prostético) llamado grupo hemo.
Cada grupo hemo contiene un átomo de hierro en estado ferroso (Fe2+). Estos son los átomos capaces de unirse al oxígeno sin oxidarse.
El tetrámero de la hemoglobina está constituido por dos subunidades de globina alfa, de 141 aminoácidos cada una, y dos subunidades de globina beta, de 146 aminoácidos cada una.
Cuando la hemoglobina no está unida a ningún átomo de oxígeno, la estructura de la hemoglobina es rígida o tensa, producto de la formación de puentes salinos en su interior.
La estructura cuaternaria de la hemoglobina sin oxígeno (desoxigenada) se conoce como estructura “T” o tensa, y la hemoglobina oxigenada (oxihemoglobina) se conoce como estructura “R” o relajada.
La transición de la estructura T a la estructura R ocurre por medio de la unión del oxígeno al átomo de hierro ferroso (Fe2+) del grupo hemo unido a cada cadena de globina.
Las subunidades que componen la estructura de la hemoglobina muestran un comportamiento cooperativo que se puede explicar con el siguiente ejemplo.
Se puede imaginar a la molécula de hemoglobina desoxigenada (en estructura T) como un ovillo de lana con los sitios de unión al oxígeno (grupos hemo) muy escondidos dentro del mismo.
Cuando esta estructura tensa se une a una molécula de oxígeno, la velocidad de unión es muy lenta, pero esta unión es suficiente para aflojar un poco el ovillo y acercar el siguiente grupo hemo hacia la superficie, haciendo que la velocidad con la que se une el siguiente oxígeno sea mayor, repitiéndose el proceso y aumentando la afinidad con cada unión.
Para poder estudiar los efectos del monóxido de carbono en el transporte sanguíneo de gases primero es necesario describir las características de la curva de la oxihemoglobina, que describe su dependencia con la presión parcial de oxígeno para “cargarse” o no de moléculas de oxígeno.
La curva de la oxihemoglobina tiene una forma sigmoidea o de “S” que varía en función de la presión parcial de oxígeno. El gráfico de la curva se desprende de los análisis que se hacen a las muestras de sangre que se utilizan para construirla.
La región más inclinada de la curva se obtiene con presiones inferiores a 60 mmHg y a mayores presiones que esta, la curva tiende a aplanarse, como si llegase a una meseta.
Cuando se está en presencia de ciertas sustancias, la curva puede mostrar desviaciones significativas. Estas desviaciones muestran cambios que se dan en la afinidad de la hemoglobina por el oxígeno a la misma PO2.
Para cuantificar este fenómeno se introdujo la medida de la afinidad de la hemoglobina por el oxígeno, conocida como el valor P50, que es el valor de presión parcial de oxígeno al cual la hemoglobina está 50% saturada; es decir, cuando la mitad de sus grupos hemo están unidos a una molécula de oxígeno.
En condiciones estándar, que deben entenderse como pH 7.4, presión parcial de oxígeno de 40 mmHg y temperatura de 37°C, la P50 bajo de un hombre adulto es de 27 mm Hg o 3,6 kPa.
La afinidad por el oxígeno de la hemoglobina contenida en los eritrocitos puede disminuir en presencia de 2,3 difosfoglicerato (2-3DPG), de dióxido de carbono (CO2), de altas concentraciones de protones o por aumento de temperatura; y lo mismo sucede con el monóxido de carbono (CO).
El monóxido de carbono es capaz de interferir con la función de transporte de oxígeno en la sangre arterial. Esta molécula es capaz de unirse a la hemoglobina y formar la carboxihemoglobina. Esto se debe a que tiene una afinidad por la hemoglobina unas 250 veces mayor que el O2, por lo que es capaz de desplazarlo aun cuando está unido a ella.
El organismo produce monóxido de carbono permanentemente, aunque en pequeñas cantidades. Este gas, incoloro e inodoro, se une al grupo hemo de la misma forma en que lo hace el O2, y normalmente existe alrededor de 1% de la hemoglobina en sangre como carboxihemoglobina.
Puesto que la combustión incompleta de la materia orgánica produce CO, la proporción de carboxihemoglobina en los fumadores es mucho más alta, pudiendo llegar a valores entre el 5 y el 15% de la hemoglobina total. El incremento crónico de la concentración de carboxihemoglobina es dañino para la salud.
Un aumento en la cantidad de CO que se inhale que genere más del 40% de carboxihemoglobina amenaza la vida. Cuando el sitio de unión del hierro ferroso está ocupado por un CO, no se puede pegar el O2.
La unión de CO produce la transición de la hemoglobina hacia la estructura R, de modo tal que la hemoglobina reduce aún más la capacidad de entrega de O2 en los capilares sanguíneos.
La carboxihemoglobina tiene un color rojo claro. Entonces, los pacientes envenenados con CO adoptan un color rosado, incluso en condición de coma y parálisis respiratoria. El mejor tratamiento para intentar salvar la vida de estos pacientes es hacer que inhalen oxígeno puro, incluso hiperbárico, para tratar de desplazar la unión del hierro con el CO.
- Fox, S. I. (2006). Human Physiology 9th Edition (pp. 501-502). McGraw-Hill press, New York, USA.
- Murray, R. K., Granner, D. K., Mayes, P. A., & Rodwell, V. W. (2014). Harper’s illustrated biochemistry. McGraw-Hill.
- Rawn, J. D. (1998). Biochemistry (1989). Burlington, North Carolina: Neil Patterson Publishers (c) N. Lalioti, CP Raptopoulou, A. Terzis, A. Panagiotopoulos, SP Perlepes, E. Manessi-Zoupa, J. Chem. Soc. Dalton Trans, 1327.
- Robert M. Berne, Matthew N. Levy. (2001) Fisiología. (3er Ed.) Ediciones Harcourt, S.A.
- West, J. B. (1991). Physiological basis of medical practice. Williams & Wilkins
