Piperidina: estructura, síntesis, derivados, reacciones
La piperidina es un compuesto orgánico cuya fórmula condensada es (CH2)5NH. Consiste de una amina secundaria cíclica, donde el grupo amino, NH, forma parte de un anillo hexagonal, el cual es heterocíclico, debido a la presencia del átomo de nitrógeno.
La piperidina viene a ser la versión nitrogenada del ciclohexano. Por ejemplo, nótese en la imagen inferior la fórmula estructural de la piperidina: es muy parecida al del ciclohexano, con la única diferencia de que uno de los grupos metilenos, CH2, ha sido sustituido por un NH.
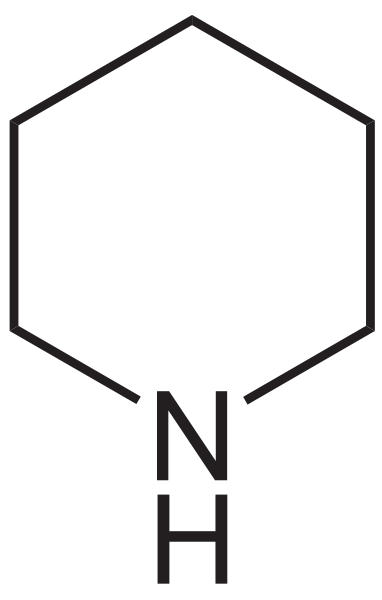
El curioso nombre de esta amina proviene de la palabra latina ‘piper’, que significa pimienta, pues fue en la pimienta negra donde por vez primera se le encontró y sintetizó. De hecho, el aroma de la piperidina se confunde por el de una mezcla de pimienta y pescado.
Su anillo hexagonal y heterocíclico se encuentra presenta además en muchos alcaloides y fármacos, por lo que la piperidina se destina para las síntesis orgánicas de tales productos; tales como la morfina, el minoxidil y la resperidona.
Índice del artículo
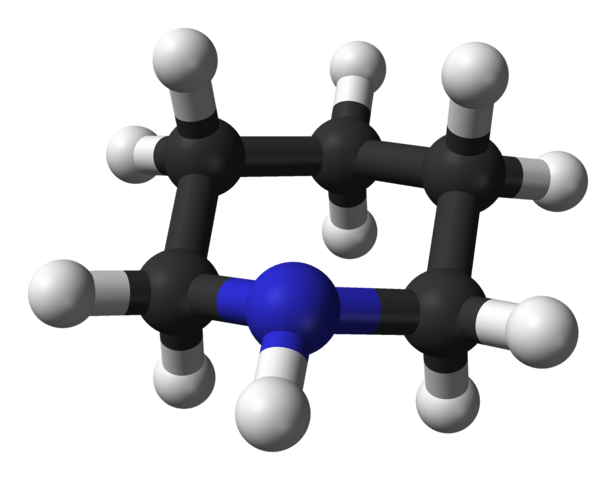
En la imagen superior tenemos la estructura molecular de la piperidina, representada por un modelo de esferas y barras. Las esferas negras, correspondientes a los átomos de carbono, componen el esqueleto que sería el mismo del ciclohexano de no ser por el átomo de nitrógeno, el de la esfera azulada.
Aquí puede verse las cinco unidades de metileno, CH2, y el modo en cómo se disponen sus átomos de hidrógeno. Asimismo, se observa claramente el grupo amino secundario, NH, cuyo nitrógeno electronegativo aporta polaridad a la molécula.
Por lo tanto, la piperidina posee un momento dipolar permanente, en el cual la densidad de carga negativa se concentra en torno al NH.
Al tener la piperidina un momento dipolar, sus fuerzas o interacciones intermoleculares son predominantemente del tipo dipolo-dipolo.
Entre las interacciones dipolo-dipolo, se encuentran presentes los puentes de hidrógeno establecidos por los grupos NH—NH de moléculas vecinas de piperidina. Como resultado, las moléculas de piperidina cohesionan en un líquido que hierve a una temperatura de 106 ºC.
El anillo hexagonal de la piperidina, al igual que el del ciclohexano, no es plano: sus átomos de hidrógeno se alternan en posiciones axiales (por encima o debajo) y ecuatoriales (dirigidos hacia los laterales). Así, la piperidina adopta varias conformaciones espaciales, siendo la silla la más importante y estable.
En la imagen anterior se muestra uno de los cuatro confómeros posibles en el que el átomo de hidrógeno del grupo NH, se ubica en posición ecuatorial; mientras que el par de electrones no compartidos del nitrógeno, se ubican en posición axial (hacia arriba, en este caso).
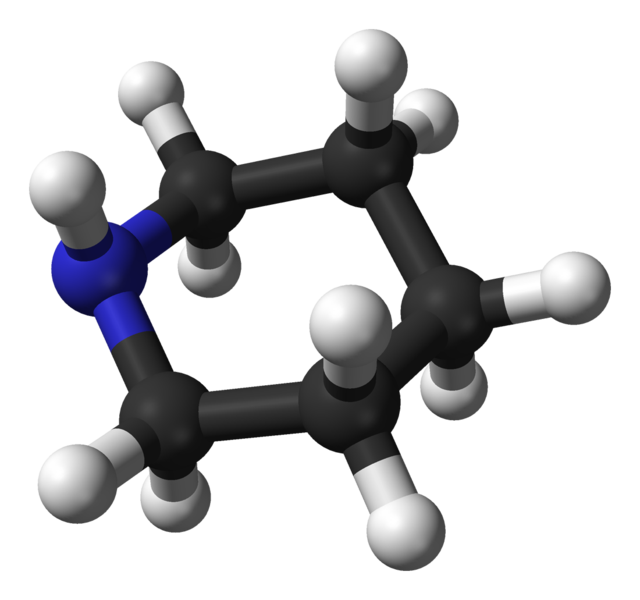
Ahora se muestra otro confórmero (imagen superior), en el que esta vez el átomo de hidrógeno del grupo NH se encuentra en posición axial (hacia arriba); y el par de electrones no compartidos del nitrógeno, en posición ecuatorial (hacia la izquierda).
De manera que en total se tienen cuatro confórmeros: dos con el hidrógeno del NH en posiciones axiales y ecuatoriales, y otros dos en los que se varían las posiciones relativas del par de electrones del nitrógeno con respecto a la silla.
Los confórmeros en los cuales el hidrógeno del NH se encuentra en posición ecuatorial, son los más estables, debido a que sufren de menores tensiones estéricas.
Las primeras síntesis de la piperidina procedieron a partir de la piperina, uno de sus derivados naturales que forma parte de la pimienta negra y es responsable de varias de las propiedades organolépticas de este condimento. La piperina se hace reaccionar con el ácido nítrico, desprendiéndose la unidad heterocíclica cuya estructura ya fue repasada.
No obstante, a escalas industriales se prefiere la síntesis de la piperidina mediante la hidrogenación catalítica de la piridina:
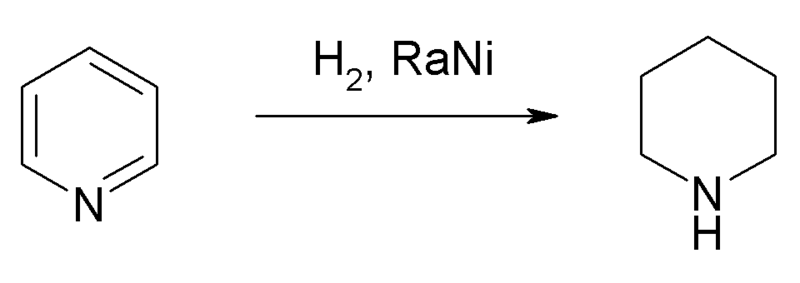
Los hidrógenos, H2, se unen al anillo de piridina rompiendo su sistema aromático, para lo cual se necesita de la ayuda de catalizadores metálicos.
Mucho más importante que la piperidina en sí misma, es su unidad estructural, reconocible en innumerables alcaloides y sustancias de origen vegetal. Por ejemplo, abajo se tiene la estructura molecular de la piperina:
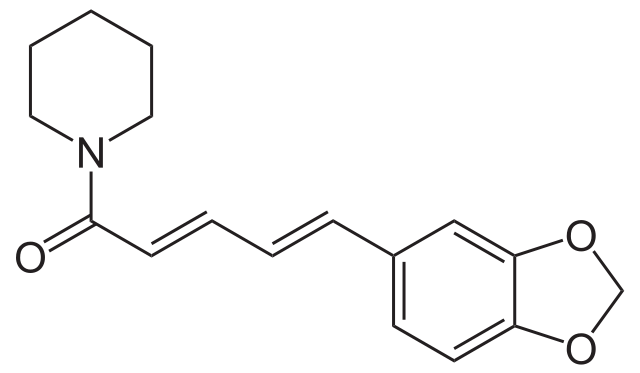
La piperina posee una estructura altamente conjugada; es decir, posee varios dobles enlaces coordinados entre sí que absorben radiación electromagnética, y que de un modo u otro, la convierten en un compuesto no tóxico para el consumo humano. Si no fuera así, la pimienta negra sería venenosa.
El anillo heterocíclico y hexagonal de la piperidina se encuentra también en la coníina, una neurotoxina extraída de la cicuta, responsable de su olor desagradable, y la cual fue además utilizada para envenenar a Sócrates. Su estructura es:
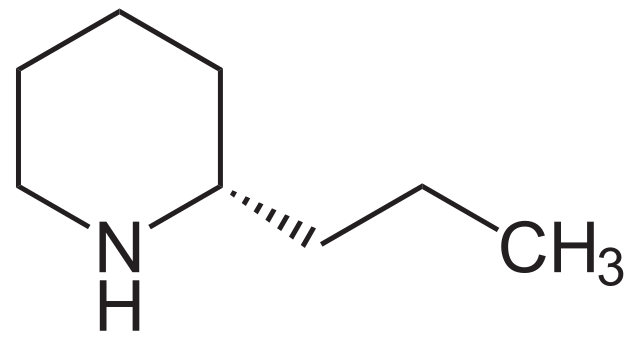
Nótese que la coniína apenas se diferencia de la piperidina por la presencia de un sustituyente propilo en el carbono adyacente al grupo NH.
Así, los derivados de la piperidina se obtienen sustituyendo los hidrógenos del anillo, o el hidrógeno del mismo grupo NH, por otros grupos o fragmentos moleculares.
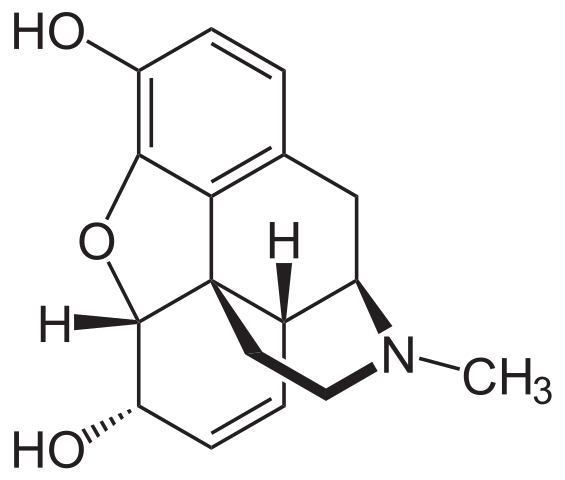
La morfina es otro de los derivados naturales de la piperidina. Esta vez el anillo de la piperidina se encuentra fusionado con otros anillos, y apunta afuera del plano, en dirección del observador. Se le identifica porque forma un enlace con el grupo CH3.
La piperidina y sus derivados se utilizan para el diseño y síntesis de distintos tipos de fármacos. Por lo tanto, son derivados sintéticos de la piperidina. Tres de ellos se enlistan a continuación junto con sus respectivas fórmulas estructurales:
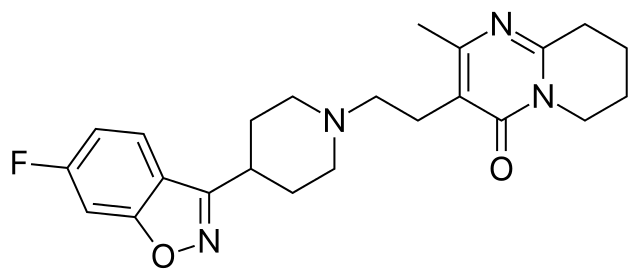
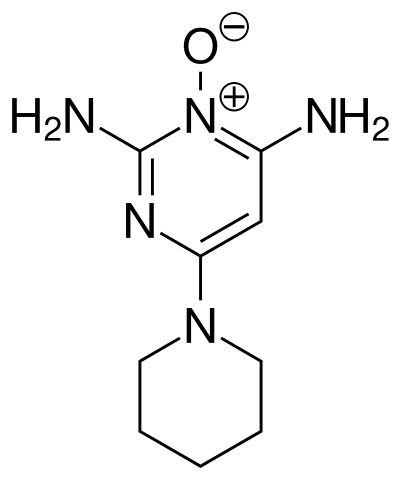
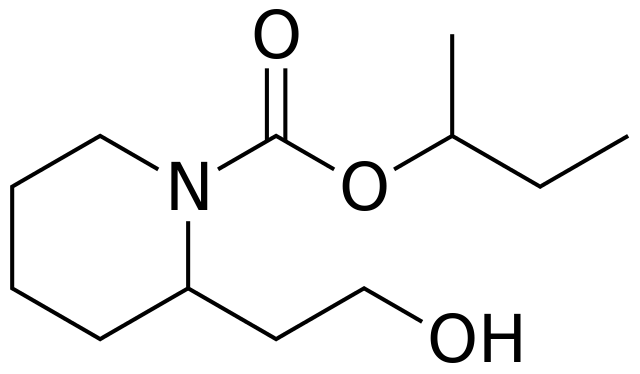
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. (10th edition.). Wiley Plus.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Morrison y Boyd. (1987). Química orgánica. (Quinta edición). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Piperidine. Recuperado de: en.wikipedia.org
- National Center for Biotechnology Information. (2020). Piperidine. PubChem Database., CID=8082. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Elsevier B.V. (2020). Piperidine. ScienceDirect. Recuperado de: sciencedirect.com
- Harold D. Banks. (1992). Piperidine Synthesis. [PDF]. Recuperado de: apps.dtic.mil
