Corrosión galvánica: mecanismos, ejemplos, protección
La corrosión galvánica o electroquímica es un proceso por el cual un metal o aleación se degrada de manera más vertiginosa en comparación a su oxidación convencional. Se puede decir que es una oxidación acelerada, e incluso, intencionalmente propiciada; como sucede en las pilas o baterías.
Esta tiene lugar bajo una serie de condiciones. En primer lugar, debe haber un metal activo, denominado ánodo. Asimismo, y en segundo lugar, debe haber un metal noble poco reactivo llamado cátodo. La tercera y cuarta condiciones son la presencia de un medio donde se propaguen los electrones, como el agua, y de especies iónicas o electrolitos.

La corrosión galvánica es observable especialmente en ambientes marinos o a orillas de las playas. Las corrientes de aire levantan masas de vapor de agua, que a su vez, arrastran algunos iones; estos últimos terminan adhiriéndose a una fina capa de agua o gotas que descansan sobre la superficie metálica.
Estas condiciones de humedad y salinidad favorecen la corrosión del metal. Es decir, que una corona de hierro como la de la imagen superior se oxidará con mayor rapidez si se expone a las cercanías del mar.
La facilidad que tendrá un metal para oxidarse comparado con otro puede medirse cuantitativamente a través de sus potenciales de reducción; en los libros de química abundan tablas con esos potenciales E. Cuanto más negativo sea, mayor será su inclinación a oxidarse.
Asimismo, si este metal está en presencia de otro con un potencial de reducción muy positivo, habiendo por lo tanto un ΔE grande, la oxidación del metal reactivo será más agresiva. Otros factores, como el pH, la fuerza iónica, la humedad, la presencia de oxígeno, y la relación entre las áreas del metal que se oxida y el que se reduce, también son importantes.
Índice del artículo
- 1 Mecanismos
- 2 Ejemplos
- 3 Protección contra la corrosión electroquímica
- 4 Experimento para niños
- 5 Referencias
Antes de abordar los mecanismos detrás de la corrosión galvánica, deben aclararse ciertos conceptos.
En una reacción rédox una especie pierde electrones (se oxida) mientras otra los gana (se reduce). El electrodo sobre el cual sucede la oxidación recibe el nombre de ánodo; y sobre el que sucede la reducción, cátodo (en inglés suele utilizarse la regla nemotécnica redcat para recordarlo).
Así, para un electrodo (una pieza, tornillo, etc.) de un metal M, si este se oxida se dice que es el ánodo:
M => Mn+ + ne–
El número de electrones liberados será igual a la magnitud de la carga positiva del catión Mn+ resultante.
Luego, otro electrodo o metal R (ambos metales deben estar en contacto de algún modo), recibe los electrones liberados; pero este no sufre una reacción química si gana electrones, ya que solo estaría conduciéndolos (corriente eléctrica).
Por lo tanto, debe haber otra especie en disolución que sí pueda aceptar formalmente estos electrones; como iones metálicos fáciles de reducir, por ejemplo:
Rn+ + ne– => R
Es decir, que se formaría una capa de metal R y el electrodo se volvería por ende más pesado; mientras que el metal M perdería masa debido a que sus átomos se disuelven.
¿Y si no hubiera cationes metálicos que puedieran reducirse con suficiente facilidad? En ese caso, otras especies presentes en el medio tomarán los electrones: los despolarizadores. Estos están íntimamente relacionados con el pH: O2, H+, OH– y H2O.
El oxígeno y agua ganan los electrones en una reacción expresada por la siguiente ecuación química:
O2 + 2H2O + 4e– => 4OH–
Mientras que los iones H+ se transforman en H2:
2H+ + 2e– => H2
Es decir, que las especies OH– y H2 son productos comunes de las corrosiones galvánicas o electroquímicas.
Aun si el metal R no participa en ninguna reacción, el hecho de ser más noble que M promueve su oxidación; y en consecuencia, habrá una mayor producción de iones OH– o gas hidrógeno. Porque, a fin de cuentas, es la diferencia entre los potenciales de reducción, ΔE, uno de los principales motores de estos procesos.
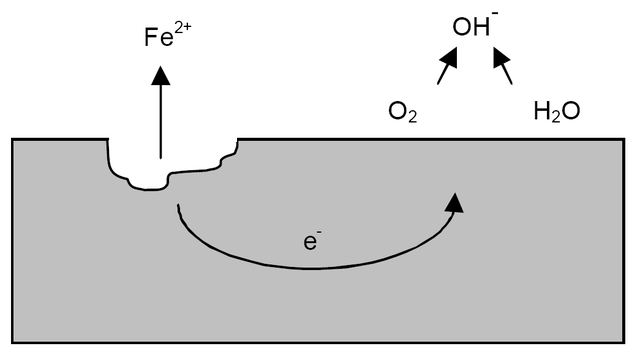
Después de las aclaraciones anteriores se puede abordar el ejemplo de la corrosión del hierro (imagen superior). Supóngase que hay una fina capa de agua en la que se disuelve el oxígeno. Sin la presencia de otros metales, serán los despolarizadores quienes marcarán las pautas de la reacción.
Así, el hierro perderá algunos átomos de su superficie para disolverse en el agua como cationes Fe2+:
Fe => Fe2+ + 2e–
Los dos electrones recorrerán la pieza de hierro por ser un buen conductor de la electricidad. De modo que se sabe dónde inició la oxidación o el sitio anódico; pero no dónde proseguirá la reducción o la ubicación del sitio catódico. El sitio catódico puede ser cualquier lugar; y cuanto mayor sea su área posible, peor será la corrosión del metal.
Supóngase que los electrones llegan a un punto tal y como se muestra en la imagen superior. Allí tanto el oxígeno como el agua sufren la reacción ya descrita, por la cual se libera OH–. Estos aniones OH– pueden reaccionar con los Fe2+ para formar Fe(OH)2, el cual precipita y sufre oxidaciones posteriores que lo transforman finalmente en herrumbre.
Mientras, el sitio anódico se va agrietando más y más.
En la vida diaria los ejemplos de corrosiones galvánicas son numerosos. No tenemos que remitirnos a la corona de hierro: cualquier artefacto hecho de metales puede sufrir el mismo proceso en presencia de ambientes húmedos y salinos.
Además de la playa, el invierno también puede aportar las condiciones ideales para que haya corrosión; por ejemplo, cuando se echan paladas de sales a la nieve de la carretera para evitar que los automóviles patinen.
Desde el punto de vista físico, en las uniones soldadas de dos metales puede retenerse humedad, siendo sitios activos de corrosión. Esto se debe a que ambos metales se comportan como dos electrodos, y el más reactivo perderá sus electrones.
Si la producción de iones OH– es considerable, puede hasta corroer la pintura del automóvil o del artefacto en cuestión.
Uno puede construir sus propios ejemplos de corrosiones galvánicas haciendo uso de las tablas de potenciales de reducción. Sin embargo, se optará por la tabla del índice anódico (simplificada de por sí) para ilustrar este punto.
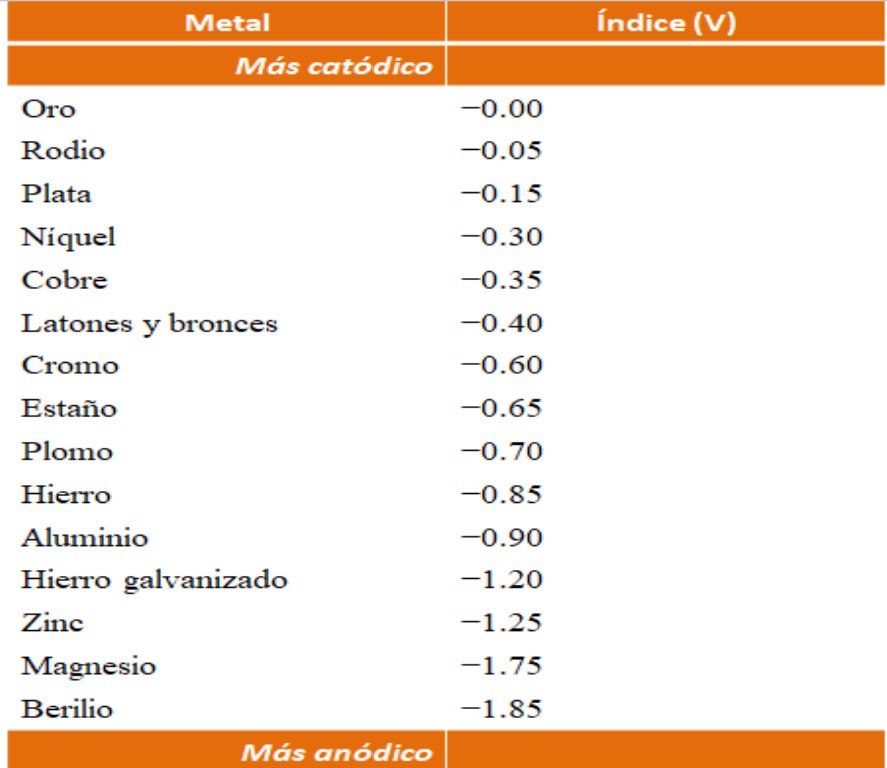
Supóngase por ejemplo que quisiéramos construir una celda electroquímica. Los metales que están el parte superior de la tabla de índices anódicos son más catódicos; es decir, que se reducen con facilidad y será por tanto difícil tenerlos en disolución. Mientras que los metales que están en la parte inferior son más anódicos o reactivos, y se corroen fácilmente.
Si escogemos el oro y berilio, ambos metales no podrían estar juntos por mucho tiempo, ya que el berilio se oxidaría con extremada rapidez.
Y si por el contrario tenemos una disolución de iones Ag+ y sumergimos en ella una barra de aluminio, esta se disolverá al mismo tiempo que precipita partículas de plata metálica. Si dicha barra se conectara a un electrodo de grafito, viajaría hasta ella los electrones para depositar electroquímicamente sobre él la plata como una película plateada.
Y si en lugar de la barra de aluminio esta fuera de cobre, la disolución se tornaría azulada por la presencia de los iones Cu2+ en el agua.
Supóngase que se pretende proteger una lámina de zinc de la corrosión en presencia de otros metales. La opción más sencilla sería añadir magnesio, el cual revestiría al zinc para que, una vez oxidado, los electrones liberados del magnesio redujeran los cationes Zn2+ de vuelta.
No obstante, la película de MgO sobre el zinc más temprano que tarde terminaría agrietándose, aportando sitios anódicos de alta densidad de corriente; esto es, la corrosión del zinc se aceleraría bruscamente justo en esos puntos.
A esta técnica de protección contra la corrosión electroquímica se le conoce como el uso de revestimientos de sacrificio. El más conocido es el zinc, utilizado en la famosa técnica llamada galvanización. En ellas, se recubre el metal M, especialmente el hierro, de zinc (Fe/Zn).
Nuevamente, el zinc se oxida y su óxido sirve para cubrir el hierro y transmitirle electrones que reduzcan los Fe2+ que puedan formarse.
Supóngase otra vez que se quiere proteger la misma lámina de zinc, pero ahora se utilizará cromo en lugar de magnesio. El cromo es más noble (más catódico, ver la tabla de índices anódicos) que el zinc, y por eso funciona como un revestimiento noble.
El problema de este tipo de revestimiento es que una vez se agriete, promoverá y acelerará aún más la oxidación del metal que esté debajo; en este caso, el zinc se corroería todavía más que estando revestido de magnesio.
Y finalmente, están otros revestimientos que consisten de pinturas, plásticos, antioxidantes, grasas, resinas, etc.
Un experimento sencillo puede idearse a partir de la misma tabla de índices anódicos. Disolviendo una cantidad razonable (menos de 10 gramos) de CuSO4·5H2O en agua, se le pide a un niño que sumerja en una placa de hierro pulido. Se toma una foto y se le permite al proceso desarrollarse por un par de semanas.
La disolución inicialmente es azulada, pero comenzará a perder coloración mientras que la placa de hierro adquiere un color cobrizo. Esto es debido a que el cobre es más noble que el hierro, y por lo tanto sus cationes Cu2+ se reducirán a cobre metálico a partir de los iones cedidos por la oxidación del hierro:
Fe => Fe2+ + 2e–
Cu2+ + 2e– => Cu
Los objetos de plata se ennegrecen con el tiempo, en especial si están en contacto con una fuente de compuestos sulfurados. Su óxido puede removerse si se sumerge el objeto en una tina de agua con bicarbonato de sodio y papel de aluminio. El bicarbonato aporta los electrolitos que facilitarán el transporte de electrones entre el objeto y el aluminio.
Como resultado, el niño podrá apreciar que el objeto pierde sus manchas negras y resplandecerá con su color plateado característico; mientras que el papel de aluminio se corroerá hasta desaparecer.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Wikipedia. (2019). Galvanic corrosión. Recuperado de: en.wikipedia.org
- Stephen Lower. (16 de junio de 2019). Electrochemical Corrosion. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
- The Open University. (2018). 2.4 Corrosion processes: galvanic corrosion. Recuperado de: open.edu
- Customer Technical Service Brush Wellman Inc. (s.f.). A Guide to Galvanic Corrosion. Brush Wellman Engineered Materials.
- Giorgio Carboni. (1998). Experiments in electrochemistry. Recuperado de: funsci.com
