Reacción reversible: características y ejemplos
Una reacción reversible es aquella que en algún punto de su transcurso alcanza un estado de equilibrio en el que las concentraciones de los reactivos y productos permanecen constantes; es decir, no varían, pues la velocidad con que se consume uno es la misma con la que aparece el otro. Se dice también que tal estado corresponde a un equilibrio dinámico.
No obstante, el equilibrio pudiera verse como una consecuencia de la reversibilidad de una reacción química; ya que en las reacciones irreversibles es imposible establecer equilibrio alguno. Para que esto suceda, los productos deben ser capaces de reaccionar entre sí, bajo condiciones específicas de presión y temperatura, originando devuelta a los reactivos.
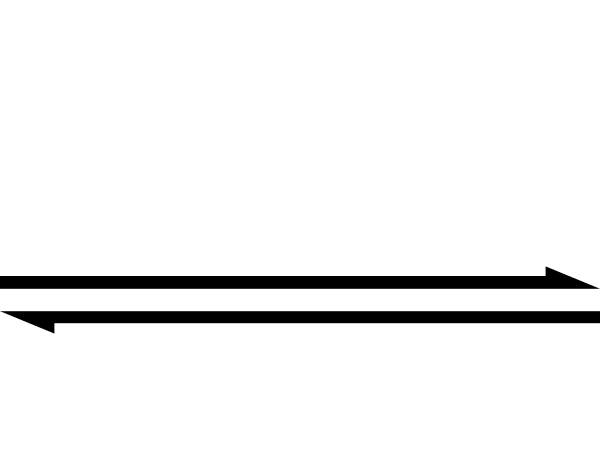
Lo anterior se sobre simplifica mediante el uso del símbolo de la doble flecha (con dos puntas antiparalelas). Cuando lo vemos en una ecuación química, significa que la reacción procede en ambas direcciones: de izquierda a derecha (formación de productos), y de derecha a izquierda (formación de reactivos o reactantes).
La minoría de las reacciones químicas es reversible, y se les encuentran más que todo en síntesis orgánicas e inorgánicas. En estas, tiene enorme importancia conocer qué condiciones favorece el equilibrio para así estimar las cantidades de producto que pueda obtenerse.
Índice del artículo
Una reacción reversible tiene la siguiente ecuación general, considerando que solo hay dos reactivos, A y B:
A + B ⇌ C + D
La doble flecha señala que A y B reaccionan para producir C y D, pero además C y D pueden reaccionar entre ellos para regenerar a los reactivos; es decir, la reacción en sentido contrario, de derecha a izquierda tiene lugar.
La reacción directa origina productos, mientras la inversa, reactivos. Si una es exotérmica, la otra por lógica debe ser endotérmica, y ambas se dan espontáneamente; pero no necesariamente a la misma velocidad.
Por ejemplo, A y B puede que sean más pequeños o inestables que C y D; y que por tanto, se consuman más rápido de lo que C y D pueda regenerarlos.
Si los productos C y D apenas reaccionan entre sí, entonces habrá una mayor acumulación de productos que de reactivos. Esto significa que cuando se alcance el equilibrio químico, tendremos mayores concentraciones de C y D que de A o B, sin importar que sus concentraciones no varíen.
Se dice entonces que el equilibrio está desplazado hacia la izquierda, donde habrá más productos que reactivos.
Una reacción reversible se caracteriza por tener lugar en ambos sentidos en una ecuación química, alcanzar un punto de equilibrio, y responder a los cambios o influencias externas siguiendo el principio de le Châtelier.
De hecho, gracias a este principio pudo explicarse las observaciones de Berthollet en 1803, cuando reconoció cristales de Na2CO3 en un lago de arena ubicado en Egipto. La reacción de doble desplazamiento vendría a ser:
Na2CO3(ac) + CaCl2(ac) ⇌ NaCl(ac) + CaCO3(ac)
Para que la reacción inversa tome lugar, tiene que haber un exceso de NaCl, y así el equilibrio se desplazaría hacia la derecha: hacia la formación de Na2CO3.
Esta característica es de gran importancia porque de igual modo se manipulan las presiones o temperaturas para favorecer el sentido de la reacción que genere la especie de interés.
Los cambios químicos de las reacciones reversibles tienden a ser menos evidentes que los observados para las reacciones irreversibles. Sin embargo, hay reacciones, especialmente aquellas donde participan complejos metálicos, en el que vemos cambios de coloración dependientes de la temperatura.
Cualquier tipo de compuesto puede estar involucrado en una reacción reversible. Se vio que dos sales son capaces de establecer un equilibrio, Na2CO3 y CaCl2. Lo mismo sucede entre complejos metálicos o moléculas. De hecho, gran parte de las reacciones reversibles se debe a moléculas con enlaces específicos que se rompen y se regeneran una y otra vez.
Una disolución de cloruro de cobalto, CoCl2, en agua la tiñe de color rosado, debido a la formación de un acuo complejo. Cuando esta disolución se calienta, el color cambia a azul, dándose la siguiente reacción reversible:
[Co(H2O)6]2+(ac) (rosado) + 4Cl–(ac) + Q ⇌ CoCl42-(ac) (azul) + 6H2O(l)
Donde Q es el calor suministrado. Este calor deshidrata el complejo, pero a medida que se enfría la disolución, o si se añade agua, volverá a su color rosado original.
La siguiente reacción reversible es quizás la más clásica en la introducción del concepto de equilibrio químico:
H2(g) + I2(s) ⇌ 2HI(g)
Nótese que la reacción logra establecer un equilibrio incluso cuando el yodo se encuentra en estado sólido. Todas las especies son moleculares: H-H, I-I y H-I.
Las hidrólisis son ejemplos muy representativos de reacciones reversibles. Entre las más simples tenemos la que sufre un ácido o base conjugados. Las hidrólisis del ion amonio, NH4+, y del ion carbonato, CO32-, son las siguientes:
NH4+(ac) + H2O(l) ⇌ NH3(g) + OH–
CO32-(ac) + H2O(l) ⇌ HCO3–(ac) + OH–
Si añadimos una base que aporte iones OH– al medio, desplazaremos ambos equilibrios hacia la izquierda.
Muy similar como en el primer ejemplo, una disolución de cromato sufre cambio de color pero debido a variaciones de temperatura sino de pH. La reacción reversible viene a ser:
2CrO42-(ac) (amarillo) + 2H3O+(ac) ⇌ Cr2O72-(ac) (anaranjado) + 3H2O(l)
Entonces, si a una disolución amarilla de CrO42- se le acidifica con cualquier ácido, su color se tornará inmediatamente anaranjado. Y si luego se alcaliniza o se añade abundante agua, el equilibrio se desplazará hacia la derecha, reapareciendo el color amarillo y consumiéndose el Cr2O72-.
La síntesis de amoníaco, NH3, involucra una reacción reversible ajustada para que el nitrógeno gaseoso, especie muy inerte, reaccione:
N2(g) + 3H2(s) ⇌ 2NH3(g)
Y para finalizar se menciona un ejemplo de la química orgánica: la esterificación. Esta consiste en la obtención de un éster a partir de un ácido carboxílico y un alcohol en medio ácido fuerte. La reacción reversible viene a ser:
RCOOH + R’OH ⇌ RCOOR’ + H2O
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Walter J. Moore. (1963). Physical Chemistry. In Chemical kinetics. Fourth edition, Longmans.
- Ira N. Levine. (2009). Principios de fisicoquímica. Sexta edición, pág 479-540. Mc Graw Hill.
- Wikipedia. (2020). Reversible reaction. Recuperado de: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (19 de agosto de 2019). Reversible Reaction Definition and Examples. Recuperado de: thoughtco.com
- Binod Shrestha. (05 de junio de 2019). Reversible and irreversible reactions. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
- David Wood. (2020). Reversible Chemical Reactions: Definition & Examples. Study. Recuperado de: study.com
