Cicloalcanos: propiedades, reacciones, usos, ejemplos
Los cicloalcanos son una familia de hidrocarburos saturados con una fórmula general de CnH2n que coincide con la de los alquenos; con la diferencia de que la aparente insaturación no se debe a un doble enlace, sino a un anillo o ciclo. Es por eso que se les considera isómeros de los alquenos.
Estos se forman cuando los alcanos lineales unen los extremos de sus cadenas para originar así una estructura cerrada. Al igual que como sucede con los alcanos, los cicloalcanos pueden exhibir distintos tamaños, masas moleculares, sustituciones o, incluso, sistemas compuestos por más de un anillo (policíclicos).

De resto, química y físicamente son similares a los alcanos. Poseen solo carbonos e hidrógenos, son moléculas neutras e interaccionan por lo tanto mediante fuerzas de Van der Walls. Asimismo, sirven como combustibles, liberando calor cuando arden en presencia de oxígeno.
¿Por qué los cicloalcanos son más inestables que sus homólogos de cadena abierta? La razón puede sospecharse observando a vuelo de pájaro los ejemplos de cicloalcanos representados en la imagen superior: existen tensiones e impedimentos estéricos (espaciales).
Nótese que cuantos menos carbonos haya (enumerados de azul), más cerrada es la estructura; y lo contrario ocurre cuando aumentan, tornándose como un collar.
Los cicloalcanos pequeños son gaseosos, y conforme se incrementan sus tamaños también lo hacen sus fuerzas intermoleculares. En consecuencia, pueden ser líquidos capaces de disolver grasas y moléculas apolares, lubricantes, o sólidos que lucen colores oscuros y cualidades como las del asfalto.
Índice del artículo
- 1 Propiedades físicas y químicas
- 2 Nomenclatura
- 3 Estructura
- 4 Reacciones
- 5 Usos
- 6 Ejemplos de cicloalcanos
- 7 Referencias
Al componerse únicamente de carbonos e hidrógenos, átomos que de por sí no difieren demasiado en electronegatividad, esto hace que las moléculas de los cicloalcanos sean apolares y por tanto carezcan de momento dipolar.
No pueden interactuar mediante fuerzas dipolo-dipolo, sino que dependen específicamente de las fuerzas de London, las cuales son débiles pero que aumentan con la masa molecular. Es por eso que los cicloalcanos pequeños (con menos de cinco carbonos) son gaseosos.
Por otro lado, al tratarse de anillos los cicloalcanos poseen una mayor área de contacto, lo cual favorece a las fuerzas de London entre sus moléculas. Así, se agrupan e interactúan de mejor modo en comparación a los alcanos; y de aquí que sus puntos de ebullición y fusión sean superiores.
Asimismo, dado que tienen dos átomos de hidrógeno menos (CnH2n para los cicloalcanos y CnH2n+2 para los alcanos), son más livianos; y sumando a esto el hecho de su mayor área de contacto, disminuye el volumen ocupado por sus moléculas, y por lo tanto, son más densos.
¿Por qué se clasifica a los cicloalcanos como hidrocarburos saturados? Porque no tienen cómo incorporar una molécula de hidrógeno; a menos que se abra el anillo, y en tal caso se convertirían en simples alcanos. Para que un hidrocarburo se considere saturado debe tener el máximo número posible de enlaces C-H.
Químicamente son muy parecidos a los alcanos. Ambos poseen enlaces C-C y C-H, los cuales no son tan fáciles de romper para originar otros productos. Sin embargo, sus estabilidades relativas difieren, lo que puede comprobarse experimentalmente mediante la medición de sus calores de combustión (ΔHcomb).
Por ejemplo, cuando se comparan el ΔHcomb para el propano y ciclopropano (representado por un triángulo en la imagen), se tiene 527,4 kcal/mol y 498,9 kcal/mol, respectivamente.
El detalle está en que el ciclopropano, con base a los calores de combustión de los alcanos, debería tener un ΔHcomb menor (471 kcal/mol) por tratarse de tres grupos metilenos, CH2; pero en realidad, libera más calor, reflejando una inestabilidad mayor que la estimada. Este exceso de energía se dice entonces que se debe a las tensiones dentro del anillo.
Y de hecho, estas tensiones rigen y diferencian la reactividad o estabilidad de los cicloalcanos, respecto a los alcanos, frente a reacciones específicas. Siempre y cuando las tensiones no sean muy elevadas, los cicloalcanos tienden a ser más estables que sus alcanos respectivos.
La nomenclatura regida por la IUPAC para los cicloalcanos no difiere demasiado que la de los alcanos. La regla más simple de todas es colocar el prefijo ciclo- al nombre del alcano del cual se forma el cicloalcano.
Así, por ejemplo, del n-hexano, CH3CH2CH2CH2CH2CH3, se obtiene el ciclohexano (representado por un hexágono en la primera imagen). De igual modo sucede con el ciclopropano, ciclobutano, etc.
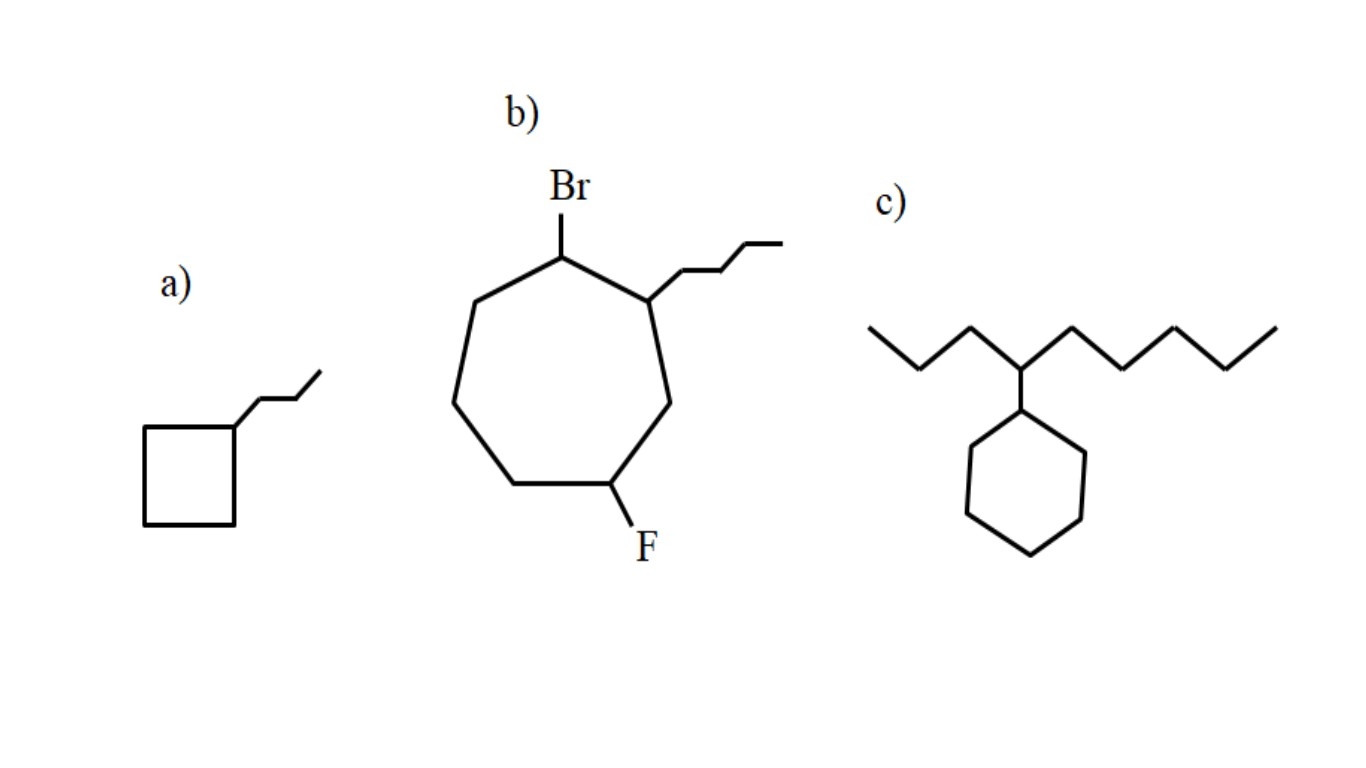
Ahora bien, estos compuestos pueden sufrir sustituciones de uno de sus hidrógenos. Cuando el número de carbonos del anillo es superior al de los sustituyentes alquilos, se toma el anillo como la cadena principal; este es el caso de a) para la imagen superior.
Nótese que en a) el ciclobutano (el cuadrado), tiene más carbonos que el grupo propilo enlazado a él; entonces a este compuesto se le nombra como propilciclobutano.
Si hay más de un sustituyente, debe nombrárseles en orden alfabético y de tal manera que tengan el menor número localizador posible. Por ejemplo, b) se llama: 1-bromo-4-fluoro-2-butilcicloheptano (y no 1-bromo-5-fluoro-7-butilcicloheptano, lo cual sería incorrecto).
Y finalmente, cuando el sustituyente alquílico tiene más carbonos que el anillo, se dice entonces que este último es el grupo sustituyente de la cadena principal. Así, c) se llama: 4-ciclohexilnonano.
Dejando a un lado los cicloalcanos sustituidos, conviene centrarse únicamente en sus bases estructurales: los anillos. Estos fueron representados en la primera imagen.
Al observarlos puede surgir la falsa idea de que tales moléculas sean planas; pero con excepción del ciclopropano, sus superficies son “zigzagueantes”, con carbonos bajando o subiendo en relación a un mismo plano.
Esto se debe a que para empezar todos los carbonos tienen hibridación sp3, y presentan por tanto geometrías tetraédricas con ángulos de enlaces de 109,5º. Pero, si se observa cuidadosamente la geometría de los anillos, es imposible que sus ángulos sean estos; por ejemplo, los ángulos dentro del triángulo del ciclopropano son 60º.
Esto es lo que se conoce como tensión angular. Cuanto más grandes sean los anillos, el ángulo entre los enlaces C-C se aproxima más a 109,5º, lo que ocasiona una disminución de dicha tensión y un incremento de la estabilidad para el cicloalcano.
Otro ejemplo se observa en el ciclobutano, cuyos ángulos de enlace son de 90º. Ya en el ciclopentano sus ángulos son de 108º, y a partir del ciclohexano se dice entonces que la tensión angular deja de ejercer un efecto desestabilizante tan remarcado.
Además de la tensión angular, hay otros factores que contribuyen a la tensión que experimentan los cicloalcanos.
Los enlaces C-C no pueden rotar sin más, ya que esto implicaría que toda la estructura se “estremeciera”. Así, estas moléculas pueden adoptar conformaciones espaciales muy bien definidas. El propósito de estos movimientos es el de reducir las tensiones ocasionadas en el eclipsamiento de los átomos de hidrógeno; es decir, cuando están uno enfrente del otro.
Por ejemplo, las conformaciones para el ciclobutano se asemejan a una mariposa que bate sus alas; las del ciclopentano, un sobre; las del ciclohexano, un bote o silla, y cuanto más grande sea el anillo, mayor es el número y formas que puedan adoptar en el espacio.

La imagen superior muestra un ejemplo de tales conformaciones para el ciclohexano. Nótese que el supuesto hexágono plano realmente parece más una silla (a la izquierda de la imagen) o un bote (a la derecha). Un hidrógeno se representa con letra roja, y otro con letra azul, para indicar cómo cambian sus posiciones relativas después de las inversiones.
En (1), cuando el hidrógeno está perpendicular al plano del anillo, se dice que está en posición axial; y cuando está paralelo a este, se dice que está en posición ecuatorial.
Las reacciones que pueden sufrir los cicloalcanos son las mismas que para los alcanos. Ambos arden en presencia de un exceso de oxígeno en las típicas reacciones de combustión para producir dióxido de carbono y agua. Asimismo, ambos pueden sufrir halogenaciones, en las cuales un hidrógeno se sustituye por un átomo de halógeno (F, Cl, Br, I).

Arriba se muestra a modo de ejemplo las reacciones de combustión y halogenación para el ciclopentano. Un mol de él arde en presencia de calor y 7,5 moles de oxígeno molecular para descomponerse en CO2 y H2O. Por otro lado, en presencia de radiación ultravioleta y bromo, sustituye un H por un Br, liberándose una molécula gaseosa de HBr.
El uso de los cicloalcanos depende en gran medida de su número de carbonos. Los más ligeros, y por tanto gaseosos, sirvieron alguna vez para alimentar las lámparas de gases de los alumbrados públicos.
Los líquidos, por su parte, tienen utilidades como solventes de aceites, grasas o productos comerciales de naturaleza apolar. Entre estos se puede mencionar al ciclopentano, ciclohexano y cicloheptano. Asimismo, suelen utilizarse con mucha frecuencia en operaciones rutinarias en laboratorios de petróleos, o en la formulación de combustibles.
Si son más pesados, pueden destinarse como lubricantes. Por otro lado, también pueden representar el material de partida para la síntesis de fármacos; como el carboplatino, el cual incluye en su estructura un anillo de ciclobutano.
Para finalizar, se regresa al principio del artículo: la imagen con varios cicloalcanos no sustituidos.
Para memorizar los cicloalcanos basta con pensar en las figuras geométricas: triángulo (ciclopropano), cuadrado (ciclobutano), pentágono (ciclopentano), hexágono (ciclohexano), heptágono (cicloheptano), decágono (ciclodecano), pentadecágono (ciclopentadecano), y así sucesivamente.
Cuanto más grande es el anillo, menos se parece a su respectiva figura geométrica. Ya se ha visto que el ciclohexano es de todo menos un hexágono; lo mismo ocurre de manera más evidente con el ciclotetradecano (de catorce carbonos).
Llega un punto en que se comportarán como collares que podrán plegarse para disminuir al máximo las tensiones de sus enlaces y eclipsamientos.
- Morrison, R. T. y Boyd, R, N. (1987). Química Orgánica. 5ta Edición. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. Amines. (10th edition.). Wiley Plus.
- Chemistry LibreTexts. (02 de junio de 2019). Naming Cycloalkanes. Recuperado de: chem.libretexts.org
- Wikipedia. (2019). Cycloalkane. Recuperado de: en.wikipedia.org
- Clark Jim. (2015). Introducing alkanes and cycloalkanes. Recuperado de: chemguide.co.uk
- James Ashenhurst. (2019). Conformations and Cycloalkanes. Master Organic Chemistry. Recuperado de: masterorganicchemistry.com
- Fernández Germán. (s.f.). Cicloalcanos-teoría. Química Orgánica. Recuperado de: quimicaorganica.org
