Nitrato de sodio (NaNO3): estructura, propiedades, usos, riesgos
El nitrato de sodio es un sólido inorgánico cristalino formado por un ion sodio Na+ y un ion nitrato NO3–. Su fórmula química es NaNO3. En la naturaleza se encuentra como el mineral nitratina o nitratita, el cual se encuentra en abundancia en el desierto de Atacama en Chile, por lo que a este mineral también se le denomina salitre de Chile o caliche.
El nitrato de sodio es un sólido no combustible pero que puede acelerar la oxidación o quemado de materiales inflamables. Por esta razón tiene amplio uso en fuegos artificiales, en explosivos, en fósforos, en ladrillos de carbón y en algunos tipos de pesticidas, para eliminar roedores y otros mamíferos pequeños.

La capacidad de favorecer la combustión o encendido de otros materiales hace que deba ser manipulado con mucha precaución. Si se expone a llamas o incendios puede explotar. A pesar de esto el NaNO3 se emplea en la industria de los alimentos pues posee propiedades conservantes, especialmente de carnes y algunos tipos de quesos.
Sin embargo, su ingestión en exceso puede causar problemas de salud, especialmente en mujeres gestantes, bebés y niños. Al transformarse en nitritos en el sistema digestivo puede ocasionar ciertas enfermedades.
Índice del artículo
- 1 Estructura química
- 2 Nomenclatura
- 3 Propiedades
- 4 Obtención
- 5 Usos
- 5.1 En la industria de los alimentos
- 5.2 En fertilizantes
- 5.3 Como promotor o favorecedor de la combustión o explosión
- 5.4 Para eliminar roedores y otros mamíferos
- 5.5 En la preparación de otros compuestos
- 5.6 En la extracción de metales de desechos electrónicos
- 5.7 En investigaciones sobre salud y ejercicio
- 5.8 En varios usos
- 6 Riesgos
- 7 Nitrato de sodio en alimentos
- 8 Referencias
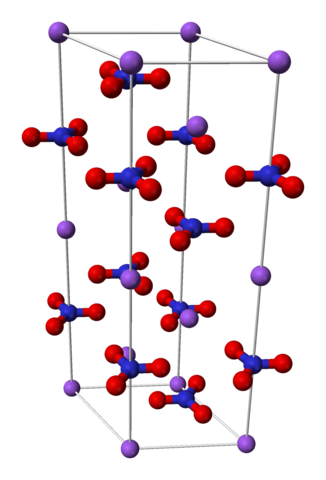
El nitrato de sodio está formado por un catión sodio Na+ y un anión nitrato NO3–.
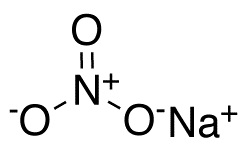
En el anión nitrato NO3– el nitrógeno N posee una valencia de +5 y el oxígeno una valencia de -2. Por esta razón el anión nitrato posee una carga negativa.
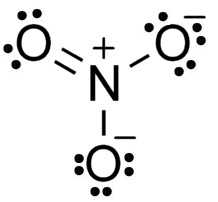
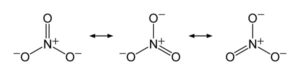
El anión NO3– tiene una estructura plana y simétrica, en la cual los tres oxígenos se reparten la carga negativa de manera equitativa o uniforme.
-Nitrato de sodio
-Nitrato sódico
-Salitre de sodio (del inglés sodium saltpeter)
-Nitro soda (del inglés soda nitre)
-Salitre de Chile
-Nitrato de Chile
-Nitratina
-Nitratita
-Caliche

Sólido incoloro a blanco, cristales trigonales o romboédricos.
84,995 g/mol
308 ºC
380 ºC (se descompone).
2,257 g/cm3 a 20 ºC.
Soluble en agua: 91,2 g/100 g de agua a 25 ºC o 1 g en 1,1 mL de agua. Ligeramente soluble en etanol y metanol.
Las soluciones de nitrato de sodio son neutras, esto es, ni ácidas ni básicas, por lo tanto su pH es 7.
Es un sólido higroscópico, es decir, absorbe agua del ambiente.

Su disolución en agua hace que la solución se enfríe, por lo que se dice que este proceso de disolución es endotérmico, en otras palabras, al disolverse absorbe calor del ambiente y por eso la solución se enfría.
A temperaturas muy bajas el nitrato de sodio es soluble en amoníaco líquido NH3, formando NaNO3·4NH3 por debajo de -42 ºC.
El NaNO3 no es combustible, pero su presencia acelera la combustión de materiales o compuestos que sí lo son. Esto se debe a que al calentarse produce oxígeno O2, entre otros gases.
Se obtiene principalmente por extracción de los depósitos minerales o minas de salitre de Chile (caliche o nitratita). Para ello se utiliza salmuera y luego se realiza la cristalización y recristalización para obtener cristales de NaNO3 más puros.
Estas minas se encuentran principalmente en Suramérica en el norte de Chile en el desierto de Atacama. Allí se encuentra asociado a nitrato de potasio KNO3 y a materia orgánica en descomposición.
También se puede obtener haciendo reaccionar ácido nítrico con carbonato de sodio Na2CO3 o con hidróxido de sodio NaOH:
2 HNO3 + Na2CO3 → 2 NaNO3 + CO2↑ + H2O
El nitrato de sodio puede entrar al organismo humano a través de la alimentación y de beber agua que lo contiene.
El 60-80% del nitrato ingerido proviene de frutas y vegetales. Una segunda fuente son las carnes curadas. La industria de la carne lo utiliza para prevenir el crecimiento de microbios y para retener el color.
Sin embargo, una alta proporción del nitrato presente en el cuerpo humano proviene de su síntesis endógena o debida a procesos dentro del organismo.
Se usa como conservante en alimentos, como agente de curado para carnes encurtidas y como agente de retención del color para las carnes. Alimentos que lo pueden contener son el tocino, las salchichas, el jamón y algunos quesos.

El nitrato de sodio se usa en mezclas fertilizantes, para fertilizar cultivos de tabaco, algodón y vegetales.

El NaNO3 se usa como oxidante en muchas aplicaciones. Es un sólido rico en oxígeno que facilita el proceso de encendido mediante la producción de O2.
La presencia del NaNO3 hace que los materiales no requieran oxígeno de fuentes externas para encenderse pues este suministra suficiente O2 como para autosostener las reacciones exotérmicas (generadoras de calor) que se producen durante la inflamación o explosión.
Se ha utilizado desde hace mucho tiempo como el oxidante principal en materiales pirotécnicos (fuegos artificiales), como componente oxidante en explosivos y agentes de detonación o estallido y como agente propulsor.

También se usa para mejorar la combustión de ladrillos de carbón (briquetas), para favorecer el encendido en fósforos e incluso para mejorar las propiedades combustibles del tabaco.
Se usa para un tipo especial de pesticidas. Las composiciones que lo contienen son fumigantes pirotécnicos que se colocan e incendian en madrigueras liberando dosis letales de gases tóxicos.
Por esta razón, se utiliza para el control de varios roedores, marmotas, coyotes y zorrillos, en campos abiertos, pastizales, áreas no cultivadas, céspedes y campos de golf.
Se usa en la manufactura de ácido nítrico HNO3, nitrito de sodio NaNO2, y también actúa como catalizador en la preparación de ácido sulfúrico H2SO4.
Se emplea en la manufactura de óxido nitroso N2O y como agente oxidante en la manufactura de compuestos farmacéuticos.
Ciertos investigadores hallaron que el NaNO3 facilita la extracción no contaminante de los metales contenidos en desechos de equipos electrónicos (celulares, tablets, computadoras, etc.).
Los metales útiles que se pueden extraer de los componentes de estos equipos electrónicos son níquel Ni, cobalto Co, manganeso Mn, cinc Zn, cobre Cu y aluminio Al.
La extracción se realiza utilizando solamente una solución de NaNO3 y un polímero. Y se alcanza un rendimiento del 60%.
De esta forma los desechos electrónicos se pueden reciclar contribuyendo a la minimización de desechos y a la recuperación estable de los recursos.
Según algunos estudios la ingestión de suplementos de NaNO3 o alimentos que lo contengan de forma natural tiene efectos positivos hacia la salud. Algunos de los alimentos ricos en nitratos son la remolacha, la espinaca y la rúcula.
Entre los efectos están el mejorar el sistema cardiovascular, reducir la presión sanguínea, mejorar el flujo de la sangre y elevar la cantidad de oxígeno en tejidos que se están ejercitando físicamente.
Esto indica que podría considerarse el uso del NaNO3 como una medicación de bajo costo en la prevención y tratamiento de pacientes con problemas de presión sanguínea.
Además, puede servir como ayuda efectiva y natural para aumentar la potencia muscular en atletas.

Se emplea como oxidante y agente fundente en la manufactura de vidrios y esmaltes para cerámica. También se usa en cementos especiales.
Sirve como agente químico en la recuperación de estaño a partir de metal chatarra, en la coagulación de látex, en la industria nuclear y en el control de la corrosión en sistemas acuosos.
Tiene la propiedad de acelerar la combustión de materiales inflamables. Si se encuentra involucrado en un incendio puede ocurrir una explosión.
Cuando se expone de forma prologada al calor o fuego puede explotar, produciéndose óxidos de nitrógeno tóxicos.
El nitrato al ser ingerido puede convertirse en nitrito tanto en la boca como en estómago e intestinos.
El nitrito al reaccionar con las aminas presentes en algunos alimentos puede convertirse en nitrosaminas en un medio ácido como en el estómago. Las nitrosaminas son cancerígenas.
Sin embargo, esto no ocurre cuando se ingieren frutas y vegetales que contienen nitratos de forma natural.
Según algunos estudios la presencia de altos niveles de nitrato puede producir un trastorno sanguíneo que hace que el oxígeno no se pueda liberar de forma efectiva en los tejidos.
Esto puede ocurrir en bebés cuya fórmula láctea se prepara con agua de pozos que contienen nitratos.
También se ha observado que los altos niveles de nitrato puede generar problemas en la gestación de bebés, causando abortos espontáneos, partos prematuros o defectos en el tubo neural de los fetos.
Recientemente se ha encontrado que el nitrato de sodio puede significar un riesgo para el desarrollo del sistema musculoesquelético y se ve afectada la comunicación nervio-músculo en los humanos.

El nitrato de sodio es sinónimo de carnes, pues junto al nitrito, se adicionan a ellas con el propósito de conservarlas y mejorar su apariencia y sabores. Por su causa, el consumo excesivo de carnes (perrocalientes, tocinos, jamones, pescado ahumado, etc.) se ha visto envuelto en el inquietante vínculo de cánceres en todo el sistema digestivo.
Si bien la relación entre carnes tratadas con sales de nitratos-nitritos y el cáncer no es absoluta, se recomienda moderar su ingesta.
Por otro lado, los vegetales (zanahorias, remolachas, rábanos, lechugas, espinacas, etc.) son ricos en NaNO3 ya que lo han absorbido de los suelos de cultivo debido a su acción fertilizante. La ingesta de estos vegetales, contrariamente al de los productos cárnicos, no se le vincula con las enfermedades citadas.
Esto se debe a dos motivos: la diferencia en los niveles proteicos de tales alimentos, y el modo en cómo se cocinan. Las carnes al freírse o calentarse a la llama se promueve la reacción entre los nitratos-nitritos con ciertos grupos de aminoácidos, para producir así nitrosoaminas: los verdaderos agentes cancerígenos.
El contenido de vitamina C, fibra y polifenoles en los vegetales reduce la formación de dichas nitrosoaminas. Es por eso que el NaNO3 por sí solo no es una amenaza para la alimentación.
- U.S. National Library of Medicine. (2019). Sodium nitrate. Recuperado de: pubchem.ncbi.nlm.nih.gov.
- Ullmann’s Encyclopedia of Industrial Chemistry. (1990). Fifth Edition. VCH Verlagsgesellschaft mbH.
- Pouretedal, H.R. and Ravanbod, M. (2015). Kinetic study of Mg/NaNO3 pyrotechnic using non-isothermal TG/DSC technique. J Therm Anal Calorim (2015) 119:2281-2288. Recuperado de link.springer.com.
- Jarosz, J. et al. (2016). Sodium nitrate decreases agrin-induced acetylcholine receptor clustering. BMC Pharmacology and Toxicology (2016) 17:20. Recuperado de bmcpharmacoltoxicol.biomedcentral.com.
- Cotton, F. Albert and Wilkinson, Geoffrey. (1980). Advanced Inorganic Chemistry. Fourth Edition. John Wiley & Sons.
- Prival, M.J. (2003). Cancer. Carcinogens in the Food Chain. In Encyclopedia of Food Sciences and Nutrition (Second Edition). Recuperado de sciencedirect.com.
- Zakhodyaeva, Y.A. et al. (2019). Complex Extraction of Metals in an Aqueous Two-Phase System Based on Poly(Ethylene Oxide) 1500 and Sodium Nitrate. Molecules 2019, 24, 4078. Recuperado de mdpi.com.
- Clements, W.T. et al. (2014). Nitrate Ingestion: A Review of the Health and Physical Performance Effects. Nutrients 2014, 6, 5224-5264. Recuperado de mdpi.com.
