¿Qué es una solución saturada? (con ejemplos)
Una solución saturada es una solución química que contiene el máximo de concentración de soluto disuelto en un solvente. Es considerada un estado de equilibrio dinámico donde las velocidades en que el solvente disuelve el soluto y la velocidad de recristalización son iguales (J., 2014).
El soluto adicional no se disolverá en una solución saturada y aparecerá en una fase distinta, ya sea un precipitado si es un sólido en líquido o una efervescencia si es un gas en un líquido (Anne Marie Helmenstine, 2016).
En la figura 1 se ilustra un ejemplo de una solución saturada. En la figura 1.1, 1.2 y 1.3 hay un volumen constante de agua en el vaso de precipitado. En la figura 1.1 comienza el proceso de saturación, donde el soluto comienza a disolverse, representado por las flechas rojas.
En la figura 1.2, gran parte del sólido se ha disuelto, pero no completamente debido al proceso de recristalización, representado por las flechas azules.
En la figura 1.3, solo una pequeña cantidad de soluto queda sin disolver. En este caso, la velocidad de recristalización es mayor que la velocidad de disolución. (tipes of saturation, 2014)
El punto de máxima concentración de un soluto en un solvente se conoce como punto de saturación.
Índice del artículo
- 1 Factores que afectan la saturación
- 2 Saturación y curvas de solubilidad
- 3 Ejemplos de soluciones saturadas
- 4 ¿Qué es una solución sobresaturada?
- 5 References
La cantidad de soluto que puede ser disuelto en un solvente va a depender de diferentes factores, entre ellos los más importantes son:
La solubilidad se incrementa con la temperatura. Por ejemplo, se puede disolver mayor cantidad de sal en agua caliente que en agua fría.
Sin embargo pueden existir excepciones, por ejemplo, la solubilidad de los gases en agua disminuye al incrementar la temperatura. En este caso, las moléculas de soluto reciben energía cinética al calentarse lo que facilita su escape.
El incremento de presión puede forzar la disolución de soluto. Esto es comúnmente utilizado para disolver gases en líquidos.
La naturaleza del soluto y del solvente y la presencia de otros compuestos químicos en la solución afectan la solubilidad. Por ejemplo, se puede disolver una mayor cantidad de azúcar en agua, que sal en agua. En este caso se dice que el azúcar es más soluble.
Etanol en agua son completamente solubles el uno con el otro. En este caso en particular, el solvente será el compuesto que se encuentre en mayor cantidad.
En contraste con la velocidad de disolución, la cual depende principalmente de la temperatura, la velocidad de recristalización depende de la concentración de soluto en la superficie de la red cristalina, caso que se favorece cuando una solución está inmóvil.
Por lo tanto, la agitación de la solución evita esta acumulación, maximizando la disolución (tipes of saturation, 2014).
Las curvas de solubilidad son una base de datos gráfica donde se compara la cantidad de soluto que se disuelve en una cantidad de solvente, a una temperatura determinada.
Las curvas de solubilidad se grafican comúnmente para una cantidad de soluto ya sea sólido o gas, en 100 gramos de agua (Brian, 2014).
En la figura 2 se ilustra las curvas de saturación para varios solutos en agua.
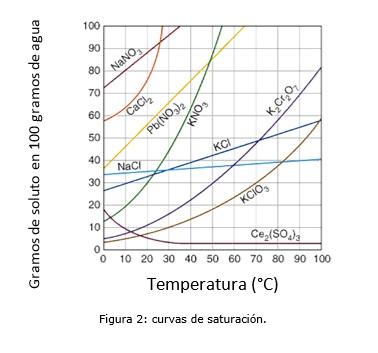
En el eje de las coordenadas se tiene la temperatura en grados centígrados, y en el eje de las abscisas se tiene la concentración de soluto expresada en gramos de soluto por cada 100 gramos de agua.
La curva indica el punto de saturación a una temperatura determinada. La zona que se encuentra debajo de la curva indica que se tiene una solución insaturada y por ende se puede agregar más soluto.
La zona por encima de la curva se tiene una solución sobresaturada. (Solubility Curves, s.f.)
Tomando como ejemplo el cloruro de sodio (NaCl), a 25 grados centígrados se puede disolver aproximadamente 35 gramos de NaCl en 100 gramos de agua para obtener una solución saturada. (Cambrige University, s.f.)
Las soluciones saturadas se pueden encontrar en el día a día, no es necesario estar en un laboratorio químico. El solvente no necesariamente tiene que ser agua. A continuación se presentan ejemplos cotidianos de soluciones saturadas:
-La soda y los refrescos en general son soluciones saturada de dióxido de carbono en agua. Es por eso, que cuando se libera la presión se forman burbujas de dióxido de carbono.
-Los suelos de tierra están saturados con nitrógeno.
-Se le puede agregar azúcar o sal al vinagre hasta formar una solución saturada.
-Agregar chocolate en polvo a la leche hasta que este no se disuelva, forma una solución saturada.
-La leche puede ser saturada con harina a tal punto que no se puede añadir más harina a la leche.
-La mantequilla derretida puede ser saturada con sal, cuando la sal ya no se disuelva.
La definición de una solución sobresaturada es aquella que contiene más soluto disuelto de lo que normalmente podría disolverse en el disolvente. Por lo general esto se hace aumentando la temperatura de la solución.
Una alteración leve de la solución o introducción de una “semilla” o diminuto cristal de soluto forzará la cristalización del exceso de soluto. Si no hay punto de nucleación para la formación de cristales, el exceso de soluto puede permanecer en solución.
Otra forma de sobresaturación puede ocurrir cuando se enfría cuidadosamente una solución saturada. Este cambio en las condiciones, significa que la concentración es realmente mayor que el punto de saturación, la solución se ha sobresaturado.
Esto se puede usar en el proceso de recristalización para purificar un producto químico: se disuelve hasta el punto de saturación en disolvente caliente, entonces a medida que el disolvente se enfría y la solubilidad disminuye, el exceso de soluto precipita.
Las impurezas, que están presentes en una concentración mucho más baja, no saturan el disolvente y permanecen así disueltas en el líquido.
- Anne Marie Helmenstine, P. (2016, julio 7). Saturated Solution Definition and Examples. Retrieved from about: about.com
- Cambrige University. (s.f.). Solubility curves. Retrieved from dynamicscience.com: dynamicscience.com.au.
- Examples of Saturated Solution. (s.f.). Retrieved from yourdcitionary: examples.yourdictionary.com.
- , S. (2014, junio 4). Saturated and Supersaturated Solutions. Retrieved from socratic.org: socratic.org.
- James, N. (s.f.). Saturated Solution: Definition & Examples. Retrieved from study.com: study.com.
- , B. (2014, octubre 14). Saturated and Supersaturated Solutions. Retrieved from socratic.org: socratic.org.
- Solubility Curves. (s.f.). Retrieved from KentChemistry: kentchemistry.com.
- Tipes of saturation. (2014, junio 26). Retrieved from chemistry libretex: chem.libretexts.org.
