Configuración electrónica de kernel: construcción, ejemplos
La configuración electrónica de kernel o compacta es aquella cuyas notaciones cuánticas del número de electrones y sus subniveles energéticos se hallan abreviadas por los símbolos de los gases nobles entre corchetes. Es muy útil a la hora de escribir configuraciones electrónicas para un determinado elemento, pues es simple y rápida.
La palabra ‘kernel’ suele referirse a las capas internas electrónicas de un átomo; es decir, aquellas en la que sus electrones no son de valencia y por tanto no participan en el enlace químico, aunque sí definen las propiedades del elemento. Metafóricamente hablando, el kernel vendría a ser el interior de la cebolla, con sus capas compuestas por una serie de orbitales crecientes en energía.
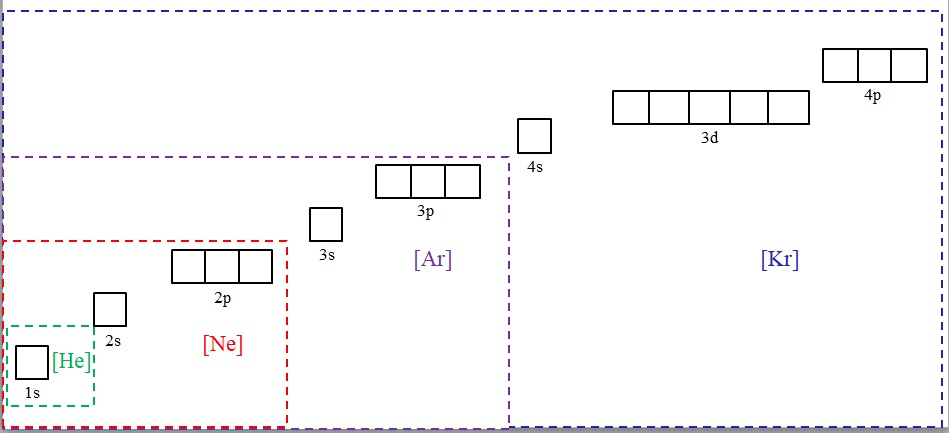
En la imagen superior se muestran los símbolos químicos para cuatro de los gases nobles entre corchetes y con distintos colores: [He] (verde), [Ne] (rojo), [Ar] (morado) y [Kr] (azul).
Cada uno de sus marcos punteados encierra casillas que representan los orbitales. Mientras más grandes sean, mayor será el número de electrones que contengan; lo que a su vez significará que las configuraciones electrónicas de más elementos podrán simplificarse con dichos símbolos. De esta manera se ahorra tiempo y energía escribiendo todas las notaciones.
Índice del artículo
Antes de utilizar las configuraciones electrónicas de kernel conviene repasar el orden correcto para construir o escribir dichas configuraciones. Este se rige de acuerdo a la regla de las diagonales o diagrama de Moeller (llamado en algunas partes método de la lluvia). Teniendo este diagrama a la mano las notaciones cuánticas quedan como sigue a continuación:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
Esta hilera de notaciones cuánticas luce extenuante; y lo sería todavía más si hubiera que escribirla todas las veces que fuera a representarse la configuración electrónica de cualquier elemento que se hallara en el período 5 en adelante. Nótese además que la hilera está vacía de electrones; no hay números en los ángulos superiores derechos (1s22s22p6…).
Debe recordarse que los orbitales s pueden “alojar” dos electrones (ns2). Los orbitales p son tres en total (mirar las tres casillas de arriba), por lo que pueden dar albergue a seis electrones (np6). Y finalmente, los orbitales d son cinco, y los f siete, teniendo en total diez (nd10) y catorce (nf14) electrones, respectivamente.
Dicho lo anterior, se procede a llenar de electrones la hilera anterior de notaciones cuánticas:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6
¿Cuántos electrones hay en total? 118. ¿Y a cuál elemento corresponde tal cantidad masiva de electrones en su átomo? Al gas noble oganesón, Og.
Supóngase que exista un elemento con un número cuántico Z igual a 119. Entonces, su configuración electrónica de valencia sería 8s1; pero, ¿cuál sería su configuración electrónica completa?
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p68s1
¿Y cuál sería su configuración electrónica de kernel, la compacta? Esta:
[Og] 8s1
Nótese la evidente simplificación o abreviación. En el símbolo [Og] se cuentan todos los 118 electrones escritos arriba, por lo que este incierto elemento tiene 119 electrones, de los cuales solo uno es de valencia (se ubicaría debajo del francio en la tabla periódica).
Supóngase ahora que se desea realizar la abreviación de manera progresiva:
[He] 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6
Nótese que 1s2 se sustituyó por [He]. El siguiente gas noble es el neón, el cual tiene 10 electrones. Sabiendo esto, la abreviación prosigue:
[Ne] 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6
Luego sigue el argón, con 18 electrones:
[Ar] 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6
Debido a que el siguiente gas noble es el kriptón, se adelanta la abreviación otros 36 electrones:
[Kr] 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6
El xenón tiene 54 electrones, y por tanto movemos la abreviación hasta el orbital 5p:
[Xe] 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6
A estas alturas se habrá notado que siempre se abrevia la configuración electrónica hasta el orbital np; es decir, los gases nobles tienen estos orbitales llenos de electrones. Y finalmente sigue el radón, con 86 electrones, por lo que abreviamos hasta el orbital 6p:
[Rn] 7s2 5f14 6d10 7p6
El oxígeno tiene ocho electrones, siendo su configuración electrónica completa:
1s22s22p4
La única abreviación que podemos utilizar es el [He] por el 1s2. Así, su configuración electrónica de kernel viene a ser:
[He] 2s22p4
El potasio tiene diecinueve electrones, siendo su configuración electrónica completa:
1s2 2s2 2p6 3s2 3p6 4s1
Nótese que podemos utilizar el símbolo [He] para abreviar dicha configuración; así como [Ne] y [Ar]. Este último es el que se utiliza debido a que el argón es el gas noble que le antecede más cercano al potasio. Por lo tanto, su configuración electrónica de kernel queda como:
[Ar] 4s1
El indio tiene cuarenta y nueve electrones, siendo su configuración electrónica completa:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p1
Ya que el kriptón es el gas noble más cercano que antecede al indio, se utiliza el símbolo [Kr] para la abreviación, y se tiene su configuración electrónica de kernel:
[Kr] 5s2 4d10 5p1
Aunque los orbitales 4d no pertenecen formalmente al kernel del indio, sus electrones no intervienen (al menos en condiciones normales) en su enlace metálico, sino los de los orbitales 5s y 5p.
El tungsteno (o wolframio) tiene 74 electrones y su configuración electrónica completa es:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d4
Nuevamente, buscamos el gas noble que le antecede más cercano. En su caso, corresponde al xenón, el cual tiene completo sus orbitales 5p. Así pues, sustituimos la hilera de notaciones cuánticas por el símbolo [Xe], y tendremos finalmente su configuración electrónica de kernel:
[Xe] 6s2 4f14 5d4
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Pat Thayer. (2016). Electron Configuration Diagrams. Recuperado de: chemistryapp.org
- Helmenstine, Anne Marie, Ph.D. (05 de diciembre de 2018). Noble Gas Core Definition. Recuperado de: thoughtco.com/
- Wikipedia. (2019). Configuración electrónica. Recuperado de: es.wikipedia.org
