Ecuación de Henderson-Hasselbalch: explicación, ejemplos, ejercicio
La ecuación de Henderson-Hasselbalch es una expresión matemática que permite el cálculo del pH de un amortiguador o solución amortiguadora. Se basa en el pKa del ácido y la relación entre las concentraciones de la base conjugada o sal y del ácido, presentes en la solución amortiguadora.
La ecuación fue inicialmente desarrollada por Lawrence Joseph Henderson (1878-1942) en el año 1907. Este químico estableció los componentes de su ecuación con base del ácido carbónico como una solución amortiguadora o tampón.
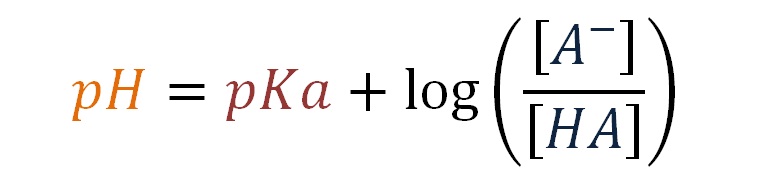
Posteriormente, Karl Albert Hasselbalch (1874-1962) introduce en 1917 el uso de los logaritmos para complementar la ecuación de Henderson. El químico danés estudió las reacciones de la sangre con el oxígeno y el efecto sobre su pH.
Una solución amortiguadora es capaz de minimizar los cambios de pH que sufre una disolución al añadirle un volumen de ácido o base fuertes. Está formada por un ácido débil y su base conjugada fuerte el cual se disocia rápidamente.
Índice del artículo
- 1 Explicación
- 2 ¿Cómo actúa una solución amortiguadora?
- 3 Ejemplos de ecuaciones de Henderson
- 4 Ejercicios resueltos
- 5 Referencias
Un ácido débil en una solución acuosa se disocia de acuerdo a la Ley de acción de masas, según el siguiente esquema:
HA + H2O ⇌ H+ + A–
HA es el ácido débil y A– su base conjugada.
Esta reacción es reversible y posee una constante de equilibrio (Ka):
Ka = [H+] ·[A–] / [HA]
Tomando logaritmos:
log Ka = log [H+] + log [A–] – log [HA]
Si se multiplica cada término de la ecuación por (-1), esta queda expresada en la forma siguiente:
– log Ka = – log [H+] – log [A] + log [HA]
El – log Ka es definido como pKa y el – log [H+] es definido como pH. Después de hacer la debida sustitución, la expresión matemática se reduce a:
pKa = pH – log [A–] + log [HA]
Despejando el pH y reagrupando términos, la ecuación se expresa en la forma siguiente:
pH = pKa + log [A–] / [HA]
Esta es la ecuación de Henderson-Hasselbalch para un amortiguador formado por un ácido débil.
En forma análoga, una base débil puede formar una solución amortiguadora y la ecuación de Henderson-Hasselbalch para ella es la siguiente:
pOH = pKb + log [HB] / [B–]
Sin embargo, la mayor parte de las soluciones amortiguadoras son originadas, inclusive las de importancia fisiológicas, a partir de la disociación de un ácido débil. Por lo tanto, la expresión más utilizada para la ecuación de Henderson-Hasselbalch es:
pH = pKa + log [A–] / [HA]
La ecuación de Henderson-Hasselbalch señala que esta solución está formada por un ácido débil y una base conjugada fuerte expresada como sal. Esta composición le permite a la solución amortiguadora permanecer con un pH estable aunque se le añadan ácidos o bases fuertes.
Al añadirle al amortiguador un ácido fuerte, este reacciona con la base conjugada para formar una sal y agua. Esto neutraliza al ácido y permite que la variación de pH sea mínima.
Ahora, si al amortiguador se le agrega una base fuerte, esta reacciona con el ácido débil y forma agua y una sal, neutralizándose la acción de la base añadida sobre el pH. Por lo tanto, la variación de pH es mínima.
El pH de una solución amortiguadora depende de la relación de las concentraciones de la base conjugada y el ácido débil, y no del valor absoluto de las concentraciones de estos componentes. Se puede diluir una solución amortiguadora con agua y el pH prácticamente no variará.
La capacidad amortiguadora depende también del pKa del ácido débil, así como de las concentraciones del ácido débil y de la base conjugada. Mientras más cercano al pKa del ácido sea el pH de la solución amortiguadora, mayor será su capacidad amortiguadora.
Asimismo, mientras mayor sea la concentración de los componentes de la solución amortiguadora mayor será su capacidad amortiguadora.
pH = pKa + log [CH3COO–] / [CH3COOH]
pKa = 4,75
pH = pKa + log [HCO3–] / [H2CO3]
pKa = 6,11
Sin embargo, el proceso global que lleva a la formación del ion bicarbonato en un organismo vivo es el siguiente:
CO2 + H2O ⇌ HCO3– + H+
Siendo el CO2 un gas, su concentración en solución se expresa en función de su presión parcial.
pH = pka + log [HCO3–] / α·pCO2
α = 0,03 (mmol/L)/mmHg
pCO2 es la presión parcial del CO2
Y entonces la ecuación quedaría como:
pH = pKa + log [HCO3–] / 0,03 · pCO2
pH = pKa + log [ion lactato] / [ácido láctico]
pKa = 3,86
pH = pKa + log [fosfato dibásico] / [fosfato monobásico]
pH = pKa + log [HPO42-] / [H2PO4–]
pKa = 6,8
pH = pKa + log [HbO2–] / [HHbO2]
pKa = 6,62
pH = pKa + log [Hb–] / HbH
pKa = 8,18
El amortiguador fosfato tiene importancia en la regulación del pH corporal, ya que su pKa (6,8) es cercano al pH existente en el organismo (7,4). ¿Cuál será el valor de la relación [Na2HPO42-] / [NaH2PO4–] de la ecuación de Henderson-Hasselbalch para un valor de pH = 7,35 y un pKa = 6,8?
La reacción de disociación del NaH2PO4– es:
NaH2PO4– (ácido) ⇌ NaHPO42- (base) + H+
pH = pKa + log [Na2HPO42-] / [NaH2PO4–]
Despejando la relación [base conjugada / ácido] para la solución amortiguadora fosfato, tenemos:
7,35 – 6,8 = log [Na2HPO42-] / [NaH2PO4–]
0,535 = log [Na2HPO42-] / [NaH2PO4–]
100,535 = 10log [Na2HPO4] / [NaH2PO4]
3,43 = [Na2HPO42-] / [NaH2PO4–]
Una solución amortiguadora de acetato tiene una concentración de ácido acético de 0,0135 M y una concentración de acetato de sodio de 0,0260 M. Calcular el pH de la solución amortiguadora, sabiendo que el pKa para el amortiguador acetato es 4,75.
El equilibrio de disociación para el ácido acético es:
CH3COOH ⇌ CH3COO– + H+
pH = pKa + log [CH3COO–] / [CH3COOH]
Sustituyendo los valores tenemos:
[CH3COO–] / [CH3COOH] = 0,0260 M / 0,0135 M
[CH3COO–] / [CH3COOH] = 1,884
log 1,884 = 0,275
pH = 4,75 + 0,275
pH = 5,025
Un amortiguador de acetato contiene 0,1 M de ácido acético y 0,1 M de acetato de sodio. Calcular el pH de la solución amortiguadora después de agregar 5 mL de ácido clorhídrico 0,05 M a 10 mL de la solución anterior.
El primer paso es calcular la concentración final del HCl al mezclarse con la solución amortiguadora:
Vi · Ci = Vf · Cf
Cf = Vi · (Ci / Vf)
= 5 mL · (0,05 M / 15 mL)
= 0,017 M
El ácido clorhídrico reacciona con el acetato de sodio para formar ácido acético. Por lo tanto, la concentración de acetato de sodio disminuye en 0,017 M y la concentración de ácido acético aumenta en la misma cantidad:
pH = pKa + log (0,1 M – 0,017 M) /(0,1 M + 0,017 M)
pH = pKa + log 0,083 / 0,017
= 4,75 – 0,149
= 4,601
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Jimenez Vargas y J. Mª Macarulla. (1984). Fisicoquímica Fisiológica. 6ª edición. Editorial Interamericana.
- Wikipedia. (2020). Henderson-Hasselbalch equation. Recuperado de: en.wikipedia.org
- Gurinder Khaira & Alexander Kot. (05 de junio de 2019). Henderson-Hasselbalch Approximation. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
- Helmenstine, Anne Marie, Ph.D. (29 de enero de 2020). Henderson Hasselbalch Equation Definition. Recuperado de: thoughtco.com
- The Editors of Encyclopaedia Britannica. (06 de febrero de 2020). Lawrence Joseph Henderson. Encyclopædia Britannica. Recuperado de: britannica.com
