Cámara de Neubauer: historia, características, usos
La cámara de Neubauer, hematímetro o hemocitómetro, es un instrumento de laboratorio que consiste en una placa de vidrio especial grueso. Esta cámara sirve para realizar recuentos de algunos tipos celulares como hematíes, glóbulos blancos y plaquetas, aunque puede ser usado para recuento de esporas, espermatozoides, parásitos, etc.
Presenta unas características muy peculiares, pues consta de 3 zonas, una central para el recuento y dos zonas de soporte. Cada cámara posee dos zonas de recuento o retículos, una en la parte superior y otra en la parte inferior.

Estos poseen múltiples divisiones en forma cuadriculada. Las zonas de contaje son los cuadros medianos que se encuentran en las 4 esquinas de ambos retículos, más el cuadrado central.
El montaje de la cámara debe realizarse con mucho cuidado, pues cualquier detalle influye en el contaje de las células. Son muchos los errores que se pueden cometer, pero si alguno de ellos ocurre se debe desmontar la cámara, limpiar y volver a montar. Entre los principales errores se pueden mencionar los siguientes:
Rebosar la cámara o realizar un llenado insuficiente, dejar secar la cámara, intentar quitar el exceso de líquido con gasa, inclinar la cámara al transportarla, llenar una cámara sucia o mojada, no mezclar bien la dilución o la muestra, entre otros. Todos estos errores darán como resultado un valor irreal.
Índice del artículo
- 1 Historia
- 2 Características de la cámara de Neubauer
- 3 Usos
- 4 ¿Cómo se usa?
- 5 Errores
- 6 Recomendación
- 7 Referencias
La cámara de Neubauer es un instrumento de precisión, y en el proceso de fabricación pasa por un estricto control de calidad. Fue creada para el recuento preciso de partículas o elementos formes por mm3, como por ejemplo células en diversos líquidos. Su delicada gráfica es tallado con lápiz de diamante.
La cámara completa es del tamaño de un portaobjeto normal para que pueda ser colocada en la platina del microscopio.
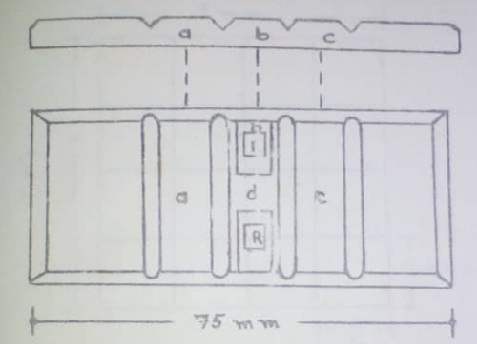
La cámara consta de tres superficies rectangulares centrales (a, b, c). En la zona “b” está ubicada la zona R o zona de recuento, también llamado retículo. Una a cada lado de la cámara, separados por la zona “d”.
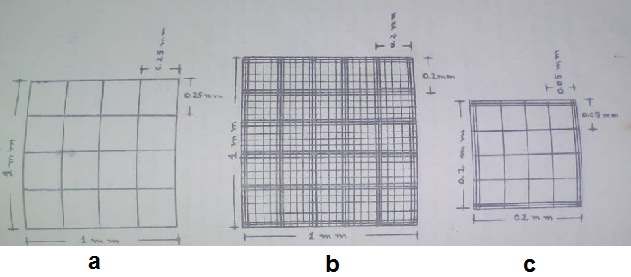
Cada retículo es una zona pulida que contiene grabada la zona de contaje. Consta de un cuadrado con una superficie de 9 mm2 y está dividido internamente en 9 cuadros con 1 mm2 de superficie cada uno. Los cuatro cuadros de las esquinas están divididos en 16 cuadrículas más pequeñas (0.0625 mm2 de superficie).
Estas cuadrículas se forman por una serie de líneas milimetradas que se entrecruzan entre sí, constituyendo cuadrículas perfectamente graficadas y delimitadas a las medidas que se han especificado. Estas líneas han sido grabadas con punta de diamante.
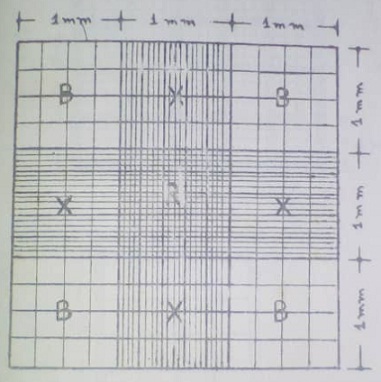
Los cuatro laterales corresponden a la zona de recuento. En estos laterales o esquinas es donde se realiza el contaje de la mayoría de las células (hematíes y leucocitos), mientras que las plaquetas se cuentan en la zona central.
La zona central tiene más divisiones, consta de un cuadrado de 1 mm2 dividido en 25 cuadros que tienen una superficie de 0,04 mm2 cada uno. Estos a su vez se dividen en 16 cuadrículas con una superficie de 0,0025 mm2.
La zona “a” y “c” sirven de soporte para colocar un cubre objeto especial que recibe el nombre de laminilla hematimétrica o cubre hematímetro.
La altura entre la laminilla y la superficie de recuento es de 0,1 mm. Las medidas de la superficie de los cuadros de conteo, así como la altura de la cámara y la dilución de la muestra, son datos necesarios para realizar los cálculos finales.
Se utiliza para el contaje de células. Especialmente es de gran ayuda en el área de hematología, ya que permite realizar el contaje de las 3 series celulares sanguíneas; es decir glóbulos rojos, glóbulos blancos y plaquetas.
Sin embargo, se puede usar en otras áreas, por ejemplo para contar espermatozoides, esporas, bacterias u otros elementos de importancia dependiendo del tipo de muestra.
Para realizar el recuento celular, por lo general se parte de una dilución previa. Ejemplo: para contar glóbulos blancos se prepara una dilución 1:20 con líquido de Turk. Se mezcla bien la dilución antes de cargar la pipeta y montar la cámara de Neubauer.
Existen ocasiones en que una dilución 1:20 no es suficiente para poder contar. Por ejemplo, en pacientes que sufren ciertos tipos de leucemias crónicas. En estos casos se deben hacer diluciones más altas como 1:100.
Si por el contrario el contaje es muy bajo, como en las leucopenias severas, se pueden hacer diluciones más pequeñas para concentrar la muestra. Ejemplo: se puede hacer una dilución 1:10.
Los cambios que se realicen influyen en los cálculos.
La cámara de Neubauer se arma colocando en la zona central la laminilla hematimétrica. Ambas deben estar muy limpias y secas. Para colocar la laminilla esta, se toma por los bordes y se deja caer suavemente sobre la cámara.
Esta se llena colocando la punta de una pipeta automática o pipeta de Thoma en un ángulo de 35° en el borde de la zona de carga. Se va descargando el líquido suavemente y la zona de carga se llena por capilaridad. Esto se realiza por ambos lados para cargar los dos retículos.
No se deben sobrecargar los retículos y tampoco se les debe negar líquido. La carga debe quedar exacta. Es importante que el llenado se realice homogéneamente, es decir, no deben quedar burbujas.
Una vez montada la cámara se deja en reposo por 2 minutos para que las células precipiten al fondo y sea más fácil su visualización y conteo.
Pasado el tiempo del reposo se monta en la platina del microscopio de luz para su observación. Primero se enfoca con objetivo de 10X y si es necesario luego se pasa a 40X.
Para mejorar su visualización se disminuye el paso de la luz del microscopio. Para ello se baja el condensador y se cierra un poco el diafragma.
Para el contaje de los glóbulos blancos o leucocitos se debe contar toda la superficie de los cuatro cuadrados medianos de las esquinas y el cuadrado central de cada retículo.
El contaje se inicia en el cuadrado de la esquina izquierda superior. Se comienza desde el primer cuadrado de la primera fila, es decir, de izquierda a derecha hasta llegar al extremo contrario.
Allí se baja y se devuelve la mirada de derecha a izquierda hasta llegar al otro extremo y así sucesivamente se van contando las células que hay dentro de cada cuadrícula en forma de zigzag. Se cuentan las 16 cuadrículas de cada cuadrado mediano.
Para evitar contar una célula dos veces existen reglas sobre las células que se ubican sobre las líneas limítrofes de cada cuadrícula. Las células que se ubiquen en las líneas izquierdas y superiores se cuentan y las que se ubiquen sobre las líneas derechas e inferiores se ignoran.
Se debe disponer de un contador de células manual para que el operador oprima la tecla del aparato tantas veces como células observe. Con el uso del contador el operador puede contar sin necesidad de levantar la mirada del campo microscópico. Al terminar el contaje observará el total de células contadas.
Para los cálculos se puede proceder de varias maneras. Se puede contar un solo retículo o se pueden contar los dos y se saca un promedio de ambos. En estas dos situaciones las células contadas se deben multiplicar por un factor, que en este caso sería 40. Y así se obtiene el contaje total por mm3.
Pero si se cuentan los dos retículos y no se saca promedio se debe multiplicar por un factor diferente, en este caso por 20.
-Factor de multiplicación
A continuación se explica cómo se calcula el factor de multiplicación.
Para los cálculos se toma en consideración varios datos, entre ellos el título de la dilución, la altura de la cámara y la superficie contada.
Dilución
La dilución que se utiliza de manera estándar es 1:20 para el contaje de leucocitos.
Altura de la cámara
La altura entre la cámara y la lámina hematimétrica es de 0,1 mm.
Superficie contada
Si se cuentan 5 cuadrados de 1mm2 de superficie, significa que la superficie total del contaje es de 5 mm2. Este dato se debe multiplicar por la altura de la cámara para obtener el volumen total contado. Es decir, 5 mm2 x 0,1 mm = 0,5 mm3.
Fórmulas y cálculos
Con los datos que se tienen se dice:
Si en 0,5 mm3 ——hay———n° de células contadas
En 1 mm3 ——-habrá —- X n° de células
X n° de células = (n° de células contadas x 1) / 0,5 mm3
Pero se debe tomar en cuenta también la dilución. Por tanto, la fórmula queda de la siguiente manera:
(n° de células contadas x 1) x 20/ 0,5 mm3
Finalmente, para resumir se puede multiplicar el n° de células contadas por 40. Así se obtiene el valor de leucocitos por mm3.
En caso de que se cuenten los dos retículos se cambia el dato de la superficie contada que en este caso sería de 10 cuadrados, es decir de 10 mm2. Y un volumen total contado de 1 mm3. La fórmula quedaría:
(n° de células contadas x 1) x 20 / 1 mm3
Por tanto, en este caso el factor de multiplicación sería 20.
-Si al cargar la cámara esta queda rebasada o sobrepasada de líquido, la altura de la cámara variará. Esto trae como consecuencia que el contaje dé más alto de lo real. Si se intenta quitar el exceso con una gasa o algodón, esto representa un error garrafal. Esta acción hará que las células se concentren, aumentando el contaje.
-Si se carga deficientemente, el contaje dará por debajo de lo real.
-En caso de que se monte la cámara y se deje secar, ya no es posible realizar el contaje debido a que emitirá resultados erróneos.
-Si antes de cargar la cámara no se mezcla bien la dilución de la muestra, se corre el riesgo de que exista error en la lectura, pues las células no estarán distribuidas de forma homogénea. Por tanto, habrá menor o mayor concentración de células, dependiendo si la muestra es tomada de la superficie del líquido o del fondo del tubo respectivamente.
-La presencia de burbujas disminuye la cantidad de líquido que debe entrar al retículo, interfiriendo con la correcta visualización y distribución de las células. Todo ello afecta significativamente los resultados.
-Durante el contaje, no levante la mirada del microscopio hasta culminar cada cuadrado grande para evitar perderse.
-Un motivo de error es inclinar la cámara después de montada. Por ello se debe subir con cuidado a la platina del microscopio.
Si por alguna razón usted detecta una anormalidad en el llenado de la cámara, lo más recomendable es que desmonte esa preparación, limpie la cámara y vuelva a montar desde cero.
Tenga mucho cuidado al limpiar la cámara para evitar el rayado de los retículos. Por otra parte, tenga en cuenta que la laminilla hematimétrica es delicada y frágil. Una manipulación inadecuada puede romperla.
Antes de comenzar a contar asegúrese de que las células hayan quedado bien distribuidas. Una distribución desigual de las células ocurre por una mezcla deficiente de la muestra o la dilución. Si esto llegase a suceder se debe repetir el montaje.
Una forma de saber si las células están bien distribuidas es comparando el contaje de cada cuadrado grande, el número de células contadas por cada cuadrado no debe ser exageradamente diferente entre uno y otro.
-Si el contaje de glóbulos blancos da por encima de 50.000 mm3 es recomendable repetir el contaje, haciendo una dilución mayor.
-Si modifica la dilución debe volver a calcular el factor de multiplicación, ya que ello influye en la fórmula.
- Cardona-Maya W, Berdugo J, Cadavid A. Comparación de la concentración espermática usando la cámara de Makler y la cámara de Neubauer. Actas Urol Esp 2008;32 (4): 443-445. Disponible en: scielo.
- Cámara de Neubauer. (2018, 27 de marzo). Wikipedia, La enciclopedia libre. Fecha de consulta: 04:10, junio 23, 2019 desde es.wikipedia.org
- Meneses A, Rojas L, Sifontes S. Aplicación de un método alternativo de conteo en Cámara de Neubauer para determinar la concentración de Trichomonas vaginalis. Rev. Cub Med Trop 2001; 53 (3): 180-8. Disponible en: researchgate.net
- Gómez-Pérez Roald E. Análisis del Espermograma. Rev. Venez. Endocrinol. Metab. 2007; 5 (2):19-20. Disponible en: ve.scielo
- Guía práctica de hematología de la Escuela de Bioanálisis de la Universidad de Carabobo. Venezuela.1998
