Adiponectina: estructura, función, receptores, mecanismo de acción
¿Qué es la adiponectina?
La adiponectina es una de las proteínas secretoras más abundantes producidas por un tipo especial de células conocidas como adipocitos, características del tejido adiposo. Se encarga de incrementar la sensibilidad frente a la insulina y está implicada en la homeostasis energética y en la obesidad.
El gen de la adiponectina humana fue clonado a partir del tejido adiposo en 1996, durante los experimentos realizados por Matsuzawa, quien la bautizó como el transcrito génico adiposo más abundante-1 (apM1, del inglés adipose most abundant gene transcript 1).
La proteína, por otra parte, fue identificada en el plasma sanguíneo ese mismo año por Nakano y colaboradores.
Esta hormona contribuye a la integración de las señales endocrinas y metabólicas que están relacionadas con el control de la homeóstasis energética. Su expresión es inducida durante la diferenciación de los adipocitos y circula en el suero a concentraciones relativamente elevadas.
Estructura
La adiponectina pertenece a la familia complemento 1q (C1q) y puede hallarse en el plasma sanguíneo en gran variedad de complejos multiméricos (de varias subunidades): trímeros, hexámeros y multímeros de alto peso molecular (de más de 18 subunidades).
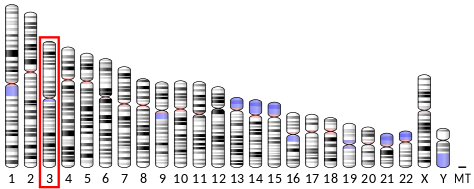
El gen que codifica para la adiponectina (ADIPOQ) está ubicado en el brazo largo del cromosoma 3 de los seres humanos, tiene 16 kilo bases y posee 3 exones. Su expresión rinde una proteína soluble en agua, compuesta de 247 residuos aminoacídicos y de poco menos de 30 kDa de peso molecular, con un punto isoeléctrico de 5.42.
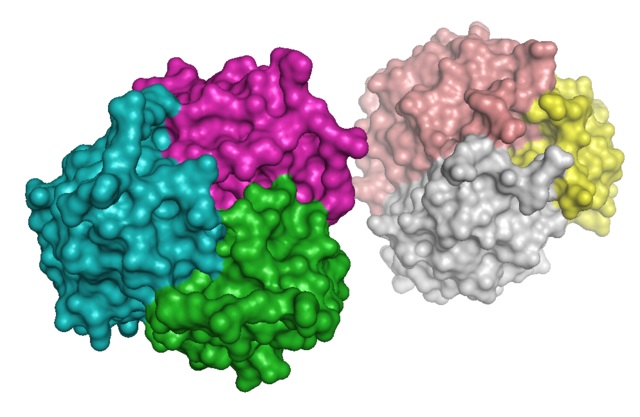
Está conformada por cuatro dominios: una secuencia señal en el extremo N-terminal, una región variable, un dominio de colágeno (cAd) y un dominio C-terminal globular.
En la porción amino terminal se distingue una secuencia tipo colágeno conocida como el dominio colágeno, que es una región de suma importancia para la formación de los multímeros y está muy conservada entre especies.
La hidroxilación y concomitante glicosilación de los residuos de lisina en el dominio colágeno de esta proteína es la que posibilita la formación de trímeros, que al mismo tiempo pueden asociarse entre sí para formar hexámeros y otros complejos de alto peso molecular.
Estos complejos aparentemente tienen especificidad de tejidos “diana”, por ejemplo los complejos de alto peso molecular son más activos en el hígado, entretanto los trímeros y los hexámeros actúan sin mucha distinción en gran variedad de tejidos.
La región globular en el extremo C-terminal, llamada dominio globular o gAd, es homóloga a proteínas como el colágeno VIII y el colágeno X, así como al factor de complemento C1q.
Función
En líneas generales, se piensa que la hormona adiponectina actúa de manera relevante en la regulación del metabolismo de los lípidos y los carbohidratos en varios tejidos insulino-sensibles.
Esta actúa sobre distintos tejidos corporales, pues sus receptores se expresan en varios sitios. Producida exclusivamente por los adipocitos, la adiponectina propicia la biosíntesis de ácidos grasos y la inhibición de la gluconeogénesis en el hígado, uno de los tejidos donde se encuentra su receptor AdipoR2.
En el músculo esquelético, donde se encuentran los receptores AdipoR1 y AdipoR2, esta promueve la oxidación de ácidos grasos y el ingreso de glucosa hacia las células musculares.
La adiponectina, además, mejora la resistencia a la insulina en algunos pacientes, ya que reduce la cantidad de grasa intracelular por activación de la oxidación de ácidos grasos tanto en el músculo como en el hígado.
Ciertos autores sugieren que esta hormona también actúa como antioxidante, como agente antiinflamatorio y como factor anti-arterioesclerótico.
Receptores
Los diferentes complejos de adiponectina parecen tener cierta preferencia sobre tejidos específicos. Estas interacciones tejido-específicas ocurren en respuesta a la expresión diferencial de diferentes tipos de receptores de adiponectina.
Los receptores de adiponectina (AdipoR) son receptores acoplados a la proteína G pertenecientes a la familia de receptores conocida como PAQR. Se conocen dos tipos: el AdipoR1 y el AdipoR2. Ambos mantienen sus dominios N-terminales en el espacio intracelular, mientras que sus dominios C-terminales son expuestos hacia el espacio extracelular.
Los receptores del tipo AdipoR1 poseen 375 aminoácidos y 42 kDa de peso molecular, mientras que los receptores del tipo AdipoR2 tienen 311 aminoácidos y un peso de 35 kDa. Ambos tienen mantienen 7 dominios transmembranales, es decir, su estructura atraviesa 7 veces la membrana plasmática de las células donde se encuentran.
Existe cerca de un 70% de homología de secuencias entre ambos receptores, con excepción de sus extremos N-terminales, que son específicos de cada uno.
Tanto AdipoR1 como AdipoR2 se expresan en todos los tejidos, aunque su abundancia varía entre uno y otro. AdipoR1 está, sobre todo, en el músculo esquelético y AdipoR2 está tanto en el músculo esquelético como en el hígado.
T-cadherina
Existe también un receptor “putativo” para la adiponectina conocido como T-cadherina, que consiste en una sola molécula de cadherina que ha perdido sus dominios citosólicos y transmembranales, y que está unida a la superficie celular a través de anclas de glicosilfosfatidilinositol (anclas GPI).
Este “receptor” de adiponectina se expresa en todos los tejidos, pero se ha reportado con mayor abundancia en el corazón, en las arterias aórticas, carótidas e ilíacas y en las arterias renales.
Mecanismo de acción
Aunque los mecanismos de producción y liberación de la adiponectina hacia el torrente circulatorio no están completamente esclarecidos, se piensa que la ruta de transducción de señales comienza con la unión de la adiponectina a los receptores membranales en sus células diana.
Dicha hormona induce la activación de la proteína quinasa activada por AMP (AMPK), lo que ocurre a través de una proteína “adaptadora” que contiene un dominio de homología a pleckstrina (típico de proteínas implicadas en procesos de señalización celular) y un dominio de unión a fosfotirosina (PTB), además de un motivo de cierre de leucina 1 (APPL).
El dominio APPL es el que se une a la porción intracelular del cualquiera de los dos receptores AdipoR. Una pequeña proteína GTPasa conocida como Rab5 se une a uno de los sitios del dominio de cierre de leucina y promueve la traslocación membranal de GLUT4, un transportador de glucosa regulado por insulina.
Además, la adiponectina actúa sobre un factor nuclear de transcripción conocido como PPARα, que es importante desde el punto de vista del metabolismo de proteínas, lípidos y carbohidratos, además de la diferenciación y el desarrollo celular.
Valores normales
Los valores normales reportados de adiponectina en el plasma sanguíneo corresponden a los complejos multiméricos de esta proteína, cuyo rango de concentración se encuentra entre 5 y 20 microgramos por mililitro, aunque también se han documentado concentraciones de hasta 30 microgramos por mililitro.
Teniendo en cuenta lo anterior, vale la pena mencionar que las concentraciones de adiponectina en el plasma varían significativamente; las mujeres, por ejemplo, tienden a tener valores más elevados que los hombres.
Los valores de esta hormona dependen enormemente del estado nutricional, de la presencia o no de alguna patología, etc., pero generalmente están inversamente correlacionados con la adiposidad y con condiciones como enfermedades cardiovasculares, hipertensión y síndromes metabólicos.
Reportes existen que aseguran que las concentraciones plasmáticas de la adiponectina disminuyen en aquellos pacientes que padecen condiciones patológicas como la resistencia a la insulina y la obesidad.
