Celdas electroquímicas: concepto, componentes, tipos, ejemplo
¿Qué son las celdas electroquímicas?
Las celdas electroquímicas son dispositivos en el que transcurren reacciones químicas donde la energía química se transforma en energía eléctrica o viceversa. Estas celdas componen el corazón de la electroquímica, siendo el alma el intercambio potencial de electrones que puede darse, espontánea o no espontáneamente, entre dos especies químicas.
Una de las dos especies se oxida, pierde electrones, mientras la otra se reduce ganando los electrones cedidos. Comúnmente la especie que se reduce es un catión metálico en disolución, que al ganar electrones termina depositándose eléctricamente sobre un electrodo hecho del mismo metal. Por otro lado, la especie que se oxida es un metal, convirtiéndose en cationes metálicos.
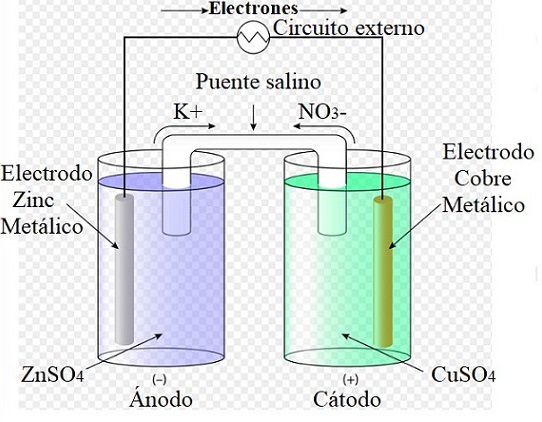
Por ejemplo, la imagen superior representa la celda de Daniel: la más simple de todas las celdas electroquímicas. El electrodo de zinc metálico se oxida, liberando cationes Zn2+ al medio acuoso. Esto ocurre en el recipiente de ZnSO4 de la izquierda.
En la derecha, la solución conteniendo CuSO4 se reduce, transformándose los cationes Cu2+ en cobre metálico que se deposita sobre el electrodo de cobre. Durante el desarrollo de esta reacción los electrones recorren un circuito externo activando sus mecanismos; y por lo tanto, aportando energía eléctrica para el funcionamiento de un equipo.
Componentes de las celdas electroquímicas
Electrodos
En las celdas electroquímicas se generan o consumen corrientes eléctricas. Para asegurar un adecuado flujo de los electrones tiene que haber materiales que sean buenos conductores de la electricidad. Es aquí donde entran los electrodos y el circuito externo, provisto de cableados de cobre, plata u oro.
Los electrodos son los materiales que aportan la superficie donde se desarrollarán las reacciones en las celdas electroquímicas. Los hay de dos tipos según la reacción que ocurre en ellos:
- Ánodo, electrodo donde ocurre la oxidación.
- Cátodo, electrodo donde ocurre la reducción.
Los electrodos pueden estar hechos de un material reaccionante, como en el caso de la celda de Daniel (zinc y cobre); o bien, de un material inerte, como sucede cuando están hechos de platino o grafito.
Los electrones cedidos por el ánodo deben llegar hacia el cátodo; pero no a través de una disolución, sino recorriendo un cable metálico que une ambos electrodos a un circuito externo.
Disolución de electrolitos
La disolución que rodea los electrodos también juega un rol importante, pues está enriquecida de electrolitos fuertes; tales como: KCl, KNO3, NaCl, etc. Estos iones favorecen hasta cierto punto la migración de los electrones desde el ánodo hacia el cátodo, así como su conducción por las cercanías de los electrodos para interaccionar con la especie a reducir.
El agua del mar, por ejemplo, conduce mucho mejor la electricidad que el agua destilada, con menor concentración de iones. Es por eso que las celdas electroquímicas cuentan con una disolución de electrolitos fuertes entre sus componentes.
Puente salino
Los iones de la disolución comienzan a rodear los electrodos ocasionando una polarización de las cargas. La disolución alrededor del cátodo comienza a cargarse negativamente, pues se están reduciendo los cationes; en el caso de la celda de Daniel, los cationes Cu2+ al depositarse como cobre metálico sobre el cátodo. Así, comienza a haber un déficit de cargas positivas.
Es aquí donde interviene el puente salino para balancear las cargas y evitar que se polaricen los electrodos. Hacia el lado o compartimiento del cátodo migrarán cationes del puente salino, ya sea K+ o Zn2+, para suplantar a los Cu2+ consumidos. Mientras, del puente salino migrarán aniones NO3– hacia el compartimiento del ánodo, para ir neutralizando la creciente concentración de cationes Zn2+.
El puente salino está compuesto de una solución saturada de sales, con sus extremos tapados por un gel permeable para los iones, pero impermeable para el agua.
Tipos de celdas electroquímicas y cómo funcionan
El modo en que una celda electroquímica funciona depende del tipo que esta sea. Las hay fundamentalmente de dos tipos: galvánicas (o voltaicas) y electrolítica
Galvánicas
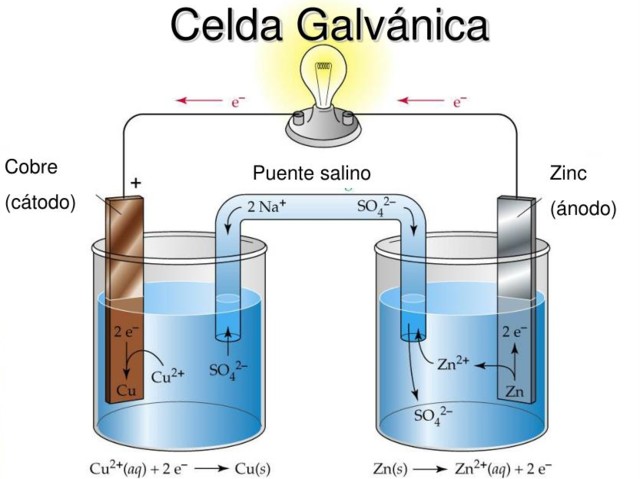
La celda de Daniel es un ejemplo de una celda electroquímica galvánica. En ellas las reacciones ocurren espontáneamente y el potencial de la pila es positivo; mientras más grande sea el potencial, mayor será la electricidad que suministrará la celda.
Las pilas o baterías son precisamente celdas galvánicas: el potencial químico entre los dos electrodos se transforma en energía eléctrica cuando interviene un circuito externo que los conecta. Así, los electrones migran del ánodo, encienden el equipo al que está conectada la pila, y se devuelven directo al cátodo.
Electrolíticas
Las celdas electrolíticas son aquellas cuyas reacciones no ocurren espontáneamente, a menos que se les suministren energía eléctrica de una fuente externa. Aquí se da el fenómeno contrario: la electricidad permite que reacciones químicas no espontáneas se desarrollen.
Una de las reacciones más conocidas y valiosas que toma lugar dentro de este tipo de celda es la electrólisis.
Las baterías recargables son ejemplos de celdas electrolíticas y a la vez galvánicas: se recargan para revertir sus reacciones químicas y reestablecer las condiciones iniciales para volver a reutilizarse.
Ejemplos
Celda de Daniel
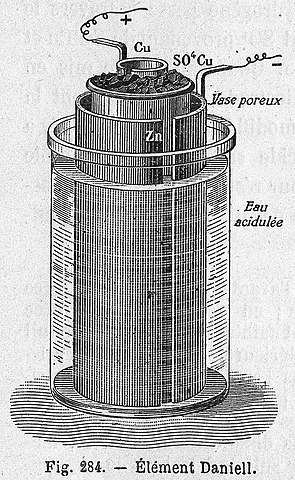
La siguiente ecuación química corresponde a la reacción de la celda de Daniel en donde participa el zinc y el cobre:
Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)
Pero los cationes Cu2+ y Zn2+ no están solos sino acompañados de los aniones SO42-. Esta celda puede representarse de la siguiente manera:
Zn | ZnSO4 | | CuSO4 | Cu
La celda de Daniel puede construirse en cualquier laboratorio, siendo muy recurrente como práctica en la introducción de la electroquímica. A medida que el Cu2+ se deposita como Cu, el color azul de la disolución CuSO4 se irá perdiendo.
Celda de platino e hidrógeno
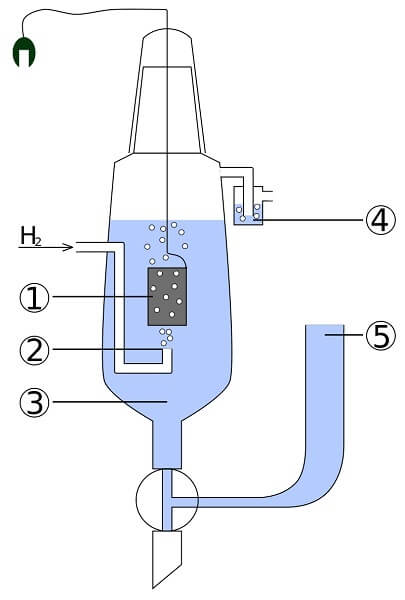
Imaginen una celda que consuma hidrógeno gaseoso, produzca plata metálica, y al mismo tiempo surta electricidad. Esta es la celda de platino e hidrógeno, y su reacción general es como sigue:
2AgCl(s) + H2(g)→ 2Ag(s) + 2H+ + 2Cl–
Aquí en el compartimiento del ánodo tenemos un electrodo inerte de platino, sumergido en agua y al cual se le bombea hidrógeno gaseoso. El H2 se oxida a H+ y cede sus electrones al precipitado lechoso de AgCl en el compartimiento del cátodo con un electrodo de plata metálica. Sobre esta plata se reducirá el AgCl y aumentará la masa del electrodo.
Esta celda puede representarse como:
Pt, H2 | H+ | | Cl–, AgCl | Ag
Celda de Downs
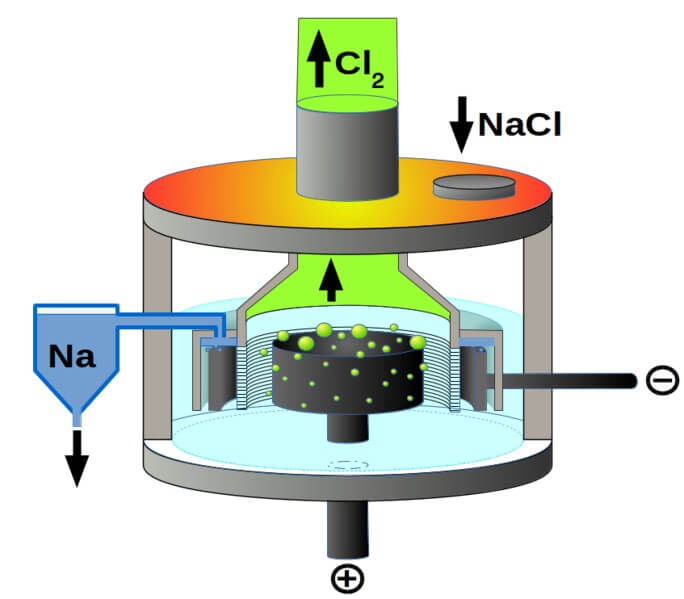
Y finalmente, entre las celdas electrolíticas tenemos la del cloruro de sodio fundido, conocida mejor como celda de Downs. Aquí se hace uso de la electricidad para que recorra a través de los electrodos un volumen de NaCl fundido, y se origine así en ellos las siguientes reacciones:
2Na+(l) + 2e– → 2Na(s) (cátodo)
2Cl–(l) → Cl2(g) + 2e– (ánodo)
2NaCl(l) → 2Na(s) + Cl2(g) (reacción global)
Así, gracias a la electricidad y cloruro de sodio puede prepararse sodio metálico y gas cloro.
