Isóbaros: qué son, características, ejemplos, diferencias con isótopos
¿Qué son los isóbaros?
Los isóbaros son aquellas especies atómicas que poseen igual masa pero que provienen de elementos químicos distintos. Como consecuencia de esto, se puede decir que los están constituidos por distintos números de protones y neutrones.
Tanto los protones como los neutrones se encuentran en el núcleo de sus átomos, pero la cantidad neta de neutrones y protones presentes en cada núcleo se mantiene igual. Dicho de otra manera, una especie isóbara se origina cuando un par de núcleos atómicos muestra el mismo número neto de neutrones y protones para cada especie.
Sin embargo, el número de neutrones y protones que constituyen esa cantidad neta es distinto. Una manera de notarlo gráficamente es observar el número másico (el cual se coloca en el lado superior izquierdo del símbolo del elemento químico que se represente), pues en los isóbaros este número es igual.
La etimología del término isóbaro proviene de los vocablos griegos isos (que significa “igual”) y baros (que significa “peso”), lo cual alude a la igualdad de pesos entre ambas especies nucleares.
Características de los isóbaros
– Los isóbaros guardan ciertas similitudes con otras especies cuyos núcleos presentan coincidencias, como los isótonos, que poseen igual cantidad de neutrones pero con número de masa y número atómico diferentes, tales como los pares 13C y 14N o 36S y 37Cl.
– El término “nucleido” es la denominación que se le ha acuñado a cada uno de los conjuntos de nucleones (estructuras conformadas por neutrones y protones) que se pueden formar. De manera que los nucleidos posiblemente se distingan por sus números de neutrones o protones, o incluso por la cantidad de energía que posea la estructura de su conglomeración.
– Igualmente, se tiene que un núcleo hijo surge luego del proceso de desintegración β y este, a su vez, es un isóbaro del núcleo padre, debido a que la cantidad de nucleones presentes en el núcleo permanece inalterada, a diferencia de lo que ocurre por medio de la desintegración α.
– Es importante recordar que los isóbaros distintos presentan distinto número atómico, confirmando que son elementos químicos distintos.
Representación
Para denotar los diferentes nucleidos se utiliza una notación específica, que se puede representar de dos maneras: una consiste en colocar el nombre del elemento químico seguido de su número másico, los cuales están unidos mediante un guión. Por ejemplo: nitrógeno-14, cuyo núcleo está constituido por siete neutrones y siete protones.
El otro modo de representar estas especies consiste en colocar el símbolo del elemento químico, precedido por un superíndice numérico que indica el número de masa que posee el átomo en cuestión, así como un subíndice numérico que designa el número atómico del mismo, de la siguiente manera:
ZAX
En esta expresión X representa el elemento químico del átomo en cuestión, A es el número másico (resultado de la adición entre la cantidad de neutrones y protones) y Z representa el número atómico (igual a la cantidad de protones en el núcleo del átomo).
Cuando se representan estos nucleidos, suele omitirse el número atómico del átomo (Z) debido a que no otorga datos adicionales relevantes, así que frecuentemente se representa como AX.
Una manera de mostrar esta notación es tomando el ejemplo anterior (nitrógeno-14), el cual se denota también como 14N. Esta es la notación empleada para los isóbaros.
Ejemplos de isóbaros
La utilización de la expresión “isóbaros” para las especies conocidas como nucleidos que poseen igual número de nucleones (igual número de masa) fue propuesta a finales de la década de 1910 por el químico de origen británico Alfred Walter Stewart.
En este orden de ideas, un ejemplo de isóbaros se puede observar en el caso de las especies 14C y 14N: el número de masa es igual a 14, esto implica que el número de protones y neutrones en ambas especies es diferente.
En efecto, este átomo de carbono posee un número atómico igual a 6, por lo que en su estructura existen 6 protones, y a su vez tiene 8 neutrones en su núcleo. Entonces su número másico es 14 (6+8=14).
Por su parte, el átomo de nitrógeno posee un número atómico igual a 7, por lo que está conformado por 7 protones, pero tiene a su vez 7 neutrones en su núcleo. Su número másico también es 14 (7+7=14).
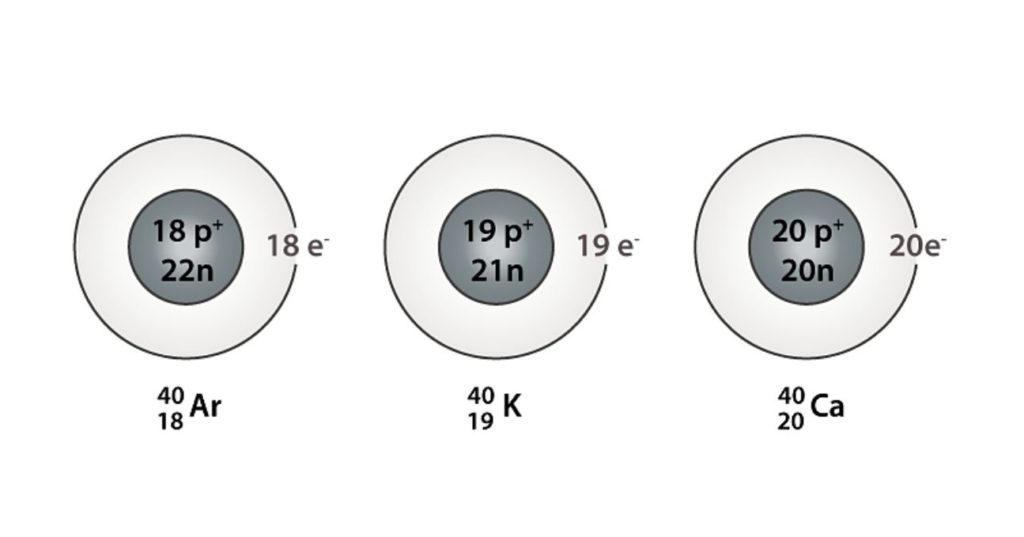
También se puede encontrar una serie en la que todos los átomos poseen un número de masa igual a 40; este es el caso de los isóbaros: 40Ca, 40K, 40Ar, 40Cl, y 40S.
Diferencias entre isóbaros e isótopos
Los nucleidos describen las diferentes clases de núcleos atómicos que existen, de acuerdo con la cantidad de protones y neutrones que posean.
Asimismo, entre estos tipos de nucleidos se encuentran los isóbaros y los isótopos, los cuales se diferenciarán a continuación.
En el caso de los isóbaros, tal como se mencionó antes, estos poseen igual número de nucleones —es decir, igual número de masa—, donde el número de protones por el que una especie es superior a la otra concuerda con el número de neutrones que se encuentran en déficit, por lo que el total es el mismo. Sin embargo, su número atómico es distinto.
En este sentido, las especies isóbaras provienen de distintos elementos químicos, así que se sitúan en distintos espacios de la tabla periódica y poseen distintas características y propiedades específicas.
Por otro lado, en el caso de los isótopos sucede lo contrario, puesto que poseen igual número atómico pero distinta cantidad de masa; es decir, poseen igual número de protones pero distinta cantidad de neutrones en el interior de sus núcleos atómicos.
Además, los isótopos son especies atómicas pertenecientes a los mismos elementos, así que se ubican en el mismo espacio de la tabla periódica y poseen características y propiedades similares.
