Incretinas: tipos, estructura, funciones, mecanismo de acción
¿Qué son las incretinas?
Las incretinas son hormonas gastrointestinales que estimulan la secreción de concentraciones fisiológicas de insulina. El término es actualmente utilizado para referirse a dos hormonas intestinales distintas, que poseen nombres técnicos diferentes: GIP o “polipéptido insulinotrópico glucosa-dependiente” y GLP-1 o “péptido 1 tipo glucagón”.
“Incretina” es una palabra y un concepto acuñado en 1932 por el fisiólogo belga Jean La Barre, quien lo introdujo para definir a los factores hormonales intestinales que complementaban los efectos de la secretina sobre la secreción pancreática endocrina.
En otras palabras, La Barre empleó el término incretina para denotar cualquier hormona intestinal que, en condiciones fisiológicas, fuera capaz de estimular o contribuir en la secreción de las hormonas pancreáticas como la insulina, el glucagón, el polipéptido pancreático (PP) y la somatostatina pancreática.
No obstante, en la actualidad el término “incretina” se emplea solo para denotar aquellas hormonas capaces de estimular la síntesis de insulina pancreática dependiente de glucosa, específicamente a dos péptidos conocidos como GIP y GLP-1. Sin embargo, el advenimiento de nuevas tecnología y estudios endocrinológicos más profundos podrían develar muchos otros péptidos con actividades similares.
Tipos de incretinas y su estructura
Tradicionalmente, en los seres humanos se han definido solo dos incretinas: el polipéptido insulinotrópico glucosa-dependiente (GIP) y el péptido 1 tipo glucagón (GLP-1); las dos hormonas funcionan aditivamente en la estimulación de la secreción de insulina.
La primera de estas en ser aislada fue el polipéptido insulinotrópico glucosa-dependiente (GIP, del inglés Glucose-dependent Insulinotropic Polypeptide). Es una hormona peptídica de unos 42 aminoácidos y que pertenece a la familia de péptidos glucagón-secretina.

La segunda incretina descubierta fue el péptido 1 tipo glucagón (GLP-1, del inglés Glucagon-Like Peptide-1), que es un subproducto del gen que codifica para la hormona “proglucagón”; parte del extremo C-terminal de la proteína, para ser más exactos.
Funciones de las incretinas
Inicialmente, las incretinas fueron definidas como los factores derivados del tracto intestinal que tienen la capacidad de disminuir los niveles plasmáticos de glucosa a través de la estimulación de la secreción de hormonas pancreáticas como la insulina y el glucagón.
Este concepto se mantuvo con el advenimiento de los radioinmunoensayos, donde se confirmó una comunicación permanente entre el intestino y el páncreas endocrino.
Se demostró que la administración oral de glucosa se asocia con importantes incrementos de los niveles plasmáticos de insulina, especialmente en comparación con los resultados obtenidos con glucosa administrada por vía intravenosa.
Se piensa que las incretinas son responsables de la secreción de casi el 70% de la insulina plasmática después de la administración oral de glucosa, pues se trata de hormonas secretadas en respuesta a la ingesta de nutrientes, lo que potencia la secreción de insulina glucosa-dependiente.
Muchos esfuerzos se están realizando en la actualidad respecto a la administración oral o intravenosa de las incretinas a pacientes con enfermedades como la diabetes mellitus de tipo 2 o la intolerancia oral a la glucosa. Esto se debe a que los estudios han demostrado, aunque preliminarmente, que dichas sustancias facilitan la rápida disminución de los niveles glucémicos después de la ingesta de alimentos.
Mecanismo de acción
GIP: Polipéptido insulinotrópico glucosa-dependiente
Esta incretina es producida por las células K del intestino delgado (en el duodeno y el yeyuno, específicamente) en respuesta a la ingestión de grasas o glucosa, y se encarga de incrementar la secreción de insulina estimulada por glucosa.
La expresión del gen codificante para este factor hormonal se ha demostrado en humanos y roedores tanto en el estómago como en el intestino. Los estudios realizados con esta hormona indican que deriva de un precursor “proGIP” de 153 aminoácidos, que posee dos péptidos señal en sus extremos N- y C-terminales, los cuales son escindidos para rendir un péptido activo de 42 residuos.
La vida media del GIP es menos de 7 minutos una vez es sintetizado y procesado enzimáticamente. Este péptido es reconocido por un receptor específico, el GIPR, que está ubicado en la membrana plasmática de las células del páncreas, en el estómago, en el intestino delgado, en el tejido adiposo, en la corteza adrenal, en la glándula pituitaria, en el corazón, en los pulmones y en otros órganos importantes.
Cuando el GIP se une a sus receptores en las células beta del páncreas, este dispara un incremento en la producción de AMPc, también la inhibición de unos canales de potasio ATP dependientes, el incremento en el calcio intracelular y, finalmente, la exocitosis de los gránulos de almacenamiento de la insulina.
Además, este péptido puede estimular la transcripción génica y la biosíntesis de la insulina, así como los demás componentes de las células beta pancreáticas para “censar” la glucosa. Aunque el GIP funcione principalmente como una hormona incretina, este también ejerce otras funciones en otros tejidos como el sistema nervioso central, los huesos, entre otros.
GLP-1: Péptido 1 tipo glucagón
Este péptido es producido a partir del gen que codifica el “proglucagón”, por lo que es un péptido que comparte cerca del 50% de identidad con la secuencia del glucagón y por ello se denomina péptido “tipo glucagón”.
GLP-1, un producto proteolítico postraduccional, es tejido específico y es producido por las células L del intestino en respuesta a la ingesta de alimentos. Al igual que el GIP, esta incretina tiene la capacidad de incrementar la secreción de insulina estimulada por glucosa.
Expresión genética y procesamiento
Este péptido es codificado en uno de los exones del gen del proglucagón, que se expresa en las células alfa del páncreas, en las células L del intestino (en el íleo distal) y en las neuronas del tallo cerebral y el hipotálamo.
En el páncreas, la expresión de dicho gen es estimulada por el ayuno y la hipoglicemia (bajas concentraciones de glucosa en sangre), y es inhibido por la insulina. En las células intestinales, la expresión del gen para el proglucagón es activada por un incremento en los niveles de AMPc y por la ingesta de alimentos.
El producto resultante de la expresión de este gen es procesado postraduccionalmente en las células L enteroendocrinas (en el intestino delgado), resultando no solo en la liberación del péptido 1 tipo glucagón, sino también en otros factores un tanto desconocidos como la glicentina, la oxintomodulina, el péptido 2 tipo glucagón, etc.
Producción y acción
La ingesta de alimentos, especialmente de aquellos ricos en grasas y carbohidratos, estimula la secreción del péptido GLP-1 a partir de las células L enteroendocrinas intestinales (también puede ocurrir estimulación nerviosa o mediada por muchos otros factores).
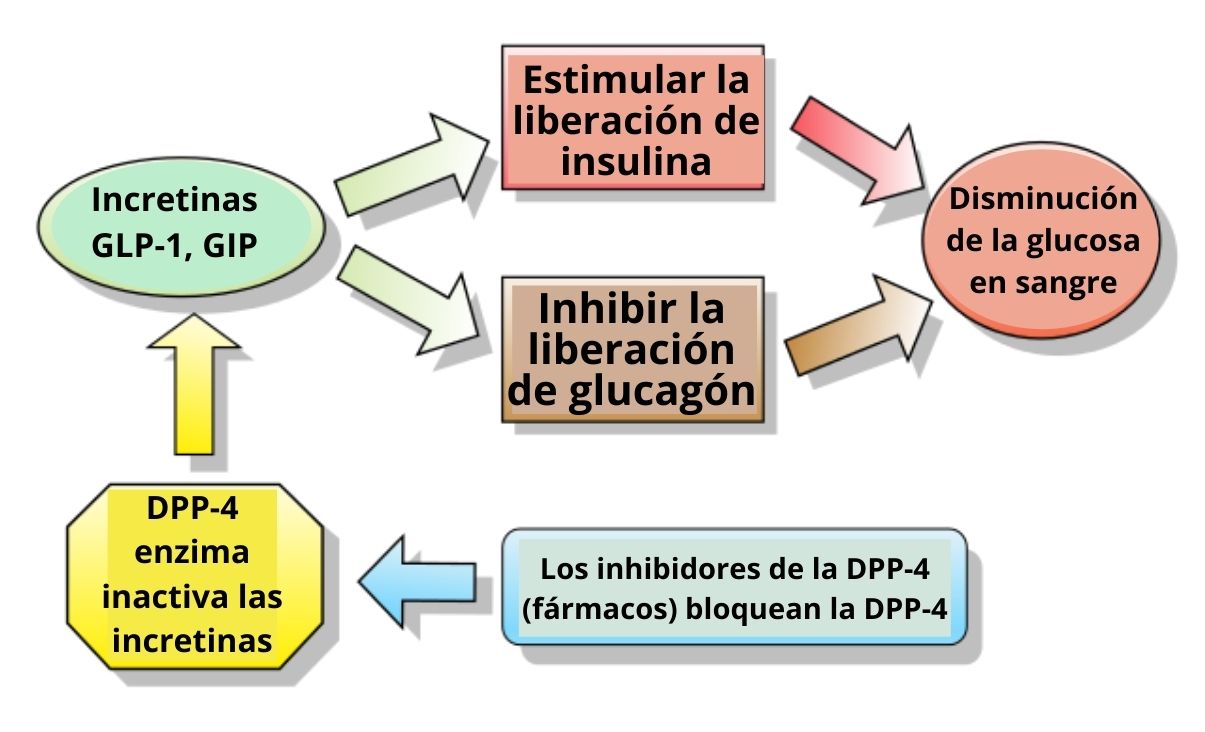
En los seres humanos y en los roedores, este péptido es liberado hacia el torrente circulatorio en dos fases: después de 10 o 15 minutos de la ingestión y posteriormente a los 30 o 60 minutos. La vida activa de esta hormona en la sangre es de menos de 2 minutos, pues es rápidamente inactivada proteolíticamente por la enzima dipeptidil peptidasa-4 (DPP-4).
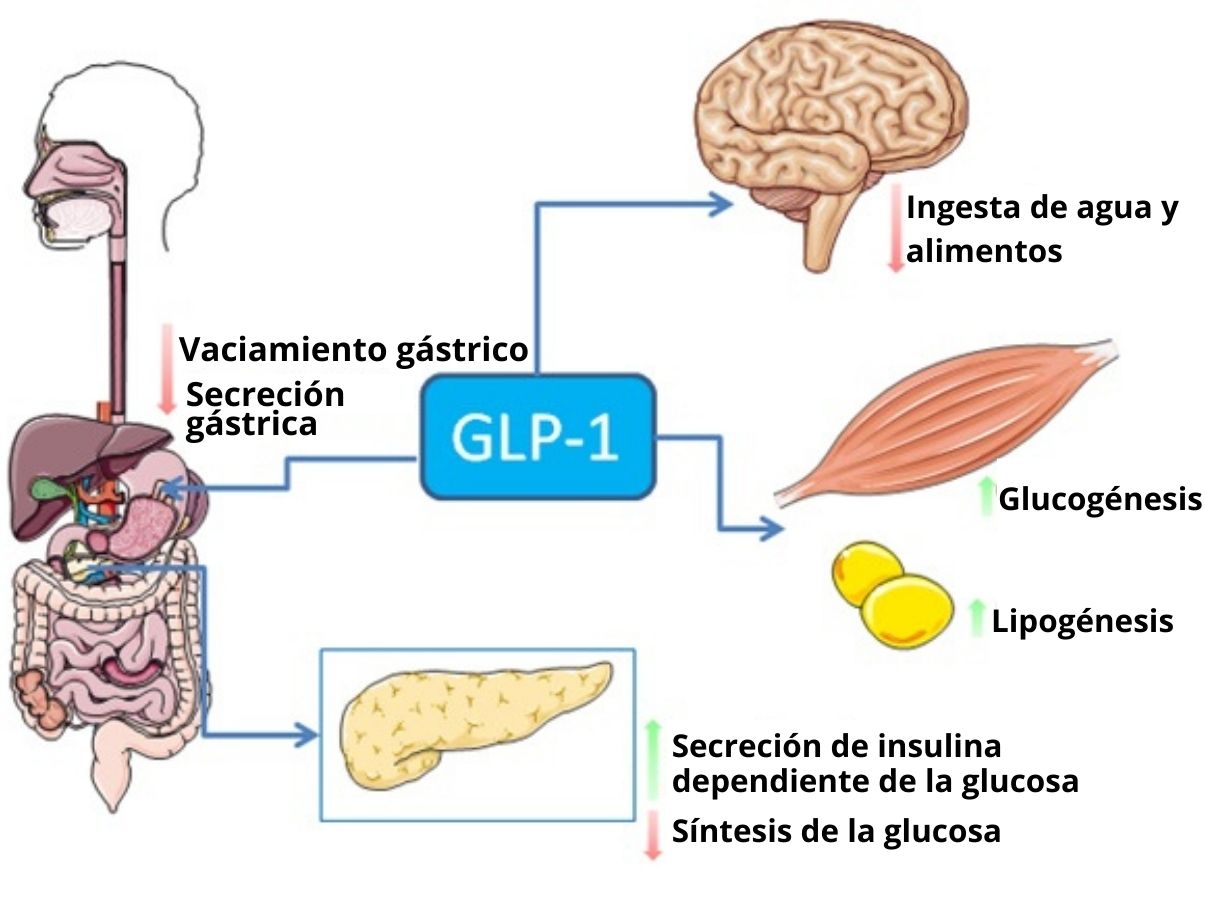
El GLP-1 se une a un receptor de membrana específico (GLP-1R) en distintas células del cuerpo, incluidas algunas de las células endocrinas del páncreas, donde estimula la secreción de insulina dependiente de glucosa.
¿Cómo?
La unión del GLP-1 a su receptor en las células beta del páncreas activa la producción de AMPc mediada por la adenilato ciclasa en dichas células. Se produce una inhibición directa de los canales de potasio ATP dependientes, lo que despolariza la membrana de las células.
Posteriormente incrementan los niveles de calcio intracelular, lo que es el resultado del influjo de calcio extracelular dependiente de GLP-1 a través de canales de calcio voltaje-dependientes, de la activación de canales catiónicos no selectivos y por la movilización de las reservas de calcio intracelulares.
También incrementa la síntesis mitocondrial de ATP, lo que favorece la despolarización. Más tarde los canales de potasio voltaje-dependientes se cierran, previniendo la repolarización de las células beta y, finalmente, ocurre la exocitosis de los gránulos de almacenamiento de insulina.
En el sistema gastrointestinal, la unión del GLP-1 a sus receptores tiene un efecto inhibitorio sobre la secreción de ácidos gástricos y el vaciado gástrico, lo que atenúa el incremento de los niveles sanguíneos de glucosa asociados con la ingesta alimenticia.
