Miofilamentos: tipos, estructura y organización
Los miofilamentos son las proteínas contráctiles de las miofibrillas, que son las unidades estructurales de las células musculares, unas células alargadas que reciben el nombre de fibras musculares.
Las fibras musculares y sus componentes tienen nombres particulares. Por ejemplo, la membrana, el citoplasma, las mitocondrias y el retículo endoplásmico se conocen como sarcolema, sarcoplasma, sarcosomas y retículo sarcoplásmico, respectivamente.
De la misma manera, los elementos contráctiles en su interior se llaman conjuntamente miofibrillas; y las proteínas contráctiles que conforman a las miofibrillas se denominan miofilamentos.
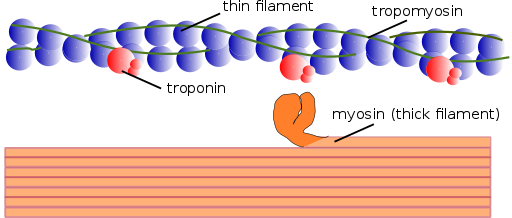
Existen dos tipos de miofilamentos: los delgados y los gruesos. Los filamentos delgados están conformados principalmente por tres proteínas: la actina F, la tropomiosina y la troponina. Los filamentos gruesos, por su parte, se componen únicamente de otra proteína conocida como miosina II.
Además de estas, existen otras proteínas asociadas tanto con los filamentos gruesos como con los delgados, pero estas no tienen funciones contráctiles, si no más bien estructurales, entre las que se encuentran, por nombrar algunas, la titina y la nebulina.
Índice del artículo
La disposición particular de los miofilamentos que constituyen las miofibrillas da origen a dos tipos de fibras musculares: las fibras musculares estriadas y las fibras musculares lisas.
Las fibras musculares estriadas, al examinarse en un microscopio óptico, muestran un patrón de estriaciones o bandas transversales que se repiten a lo largo de toda su superficie y que le otorgan el nombre, al músculo que las contiene, de músculo estriado. Existen dos tipos de fibras musculares estriadas, las esqueléticas y las cardíacas.
Las fibras musculares que no muestran ese patrón de bandas transversales reciben el nombre de fibras lisas. Son las que conforman la musculatura propia de las paredes vasculares y de las vísceras.
Estos miofilamentos están compuestos por actina F y por dos proteínas asociadas: la tropomiosina y la troponina, que tienen funciones reguladoras.
La actina F, o actina filamentosa, es un polímero de otra proteína globular más pequeña llamada actina G o actina globular, de alrededor de 42 kDa de peso molecular. Tiene un sitio de unión para la miosina, y se ordena formando dos cadenas dispuestas como una doble hélice compuesta aproximadamente de 13 monómero por giro.
Los filamentos de actina F se caracterizan por tener dos polos: uno positivo, dirigido hacia el disco Z, y otro negativo, dispuesto hacia el centro del sarcómero.
La tropomiosina también está conformada por una doble cadena polipeptídica en forma de doble hélice. Es una proteína de 64 kDa que forma filamentos que se ubican en los surcos que dejan las cadenas de doble hélice de los filamentos delgados de actina F, como “llenando” los espacios vacíos en la hélice.
En reposo, la tropomiosina cubre o “tapa” los sitios de unión de la actina para la miosina, impidiendo la interacción de ambas proteínas, que es la que origina la contracción muscular. Alrededor de cada filamento delgado y a unos 25 o 30ηm del inicio de cada tropomiosina se encuentra otra proteína llamada troponina.
La troponina (Tn) es un complejo proteico compuesto por tres subunidades de polipéptidos globulares llamados troponina T, C e I. Cada molécula de tropomiosina posee un complejo de troponina asociado que la regula, y juntas se encargan de la regulación del inicio y la finalización de la contracción muscular.
Los filamentos gruesos son polímeros de miosina II, que pesa 510 kDa y que está formada por dos cadenas pesadas de 222 kDa cada una y cuatro cadenas livianas. Las cadenas livianas son de dos tipos: cadenas livianas esenciales, de 18 kDa, y cadenas livianas reguladoras de 22 kDa.
Cada cadena pesada de miosina II tiene la forma de un bastón con una pequeña cabeza globular en su extremo que se proyecta casi a 90⁰ y que posee dos sitios de fijación, uno para la actina y otro para el ATP. Es por esto por lo que estas proteínas pertenecen a la familia de las ATPasas.
Un filamento grueso está formado por más de 200 moléculas de miosina II. La cabeza globular de cada una de estas moléculas actúa como un “remo” durante la contracción, empujando a la actina a la que está unida para que esta se deslice hacia el centro del sarcómero.
En una fibra muscular estriada esquelética, las miofibrillas ocupan la mayor parte del sarcoplasma, y están dispuestas en conjuntos longitudinales y ordenados a lo largo de la célula.
En un corte longitudinal visto con un microscopio óptico se observan bandas claras, llamadas Bandas I, y bandas oscuras, llamadas Bandas A. Estas bandas corresponden a la disposición ordenada de las miofibrillas, y por ende de los miofilamentos que las componen.
En el centro de la Banda I se observa una línea oscura y delgada que se denomina Línea o Disco Z. El centro de cada Banda A presenta una zona más clara conocida como Banda H, que está dividida centralmente por una línea más oscura llamada Línea M.
Delimitada entre dos líneas Z, se describe una estructura denominada sarcómero, que es la unidad funcional del musculo esquelético. Un sarcómero está compuesto por los miofilamentos contráctiles dispuestos ordenadamente en las bandas A, H y una hemi-banda I en cada extremo.
Las bandas I contienen solo filamentos delgados, la banda A contiene filamentos gruesos entrelazados en sus dos extremos con filamentos finos y la banda H solo contiene filamentos gruesos.
Tanto los miofilamentos gruesos como los miofilamentos delgados pueden observarse al examinar una muestra de músculo estriado esquelético al microscopio electrónico. Se dice que estos que se “interdigitan” o “entrelazan” unos con otros en una disposición secuencial, ordenada y paralela.
Los filamentos delgados se originan en los discos Z y se extienden a cada lado en sentido opuesto y hacia el centro de cada sarcómero adyacente. Desde los discos Z en cada extremo del sarcómero, en el músculo relajado, la actina llega hasta el inicio de la banda H de cada lado.
Así pues, en las fibras musculares del músculo esquelético relajado los miofilamentos gruesos ocupan la zona central que forma las bandas oscuras o bandas A; y los filamentos delgados se extienden a ambos lados del sarcómero sin alcanzar el centro del mismo.
En un corte transversal en la región donde los filamentos gruesos y delgados se superponen, se puede observar un patrón hexagonal que incluye al filamento grueso en el centro y seis filamentos delgados que lo rodean, y que se ubican en cada una de las aristas del hexágono.
Esta organización de los miofilamentos en el sarcómero se conserva por la función de una serie de proteínas asociadas a los miofilamentos y que tienen funciones estructurales, entre las que se pueden destacar la titina, la actina alfa, la nebulina, la miomesina y la proteína C.
Cuando se libera acetil colina (un neurotransmisor) en la placa neuromuscular por la estimulación de una neurona motora, se excita la fibra muscular y se abren los canales de calcio voltaje-dependientes del retículo sarcoplásmico.
El calcio se une a la troponina C, y esto genera un cambio conformacional en la tropomiosina, que expone los sitios activos de la actina, iniciando así la contracción. Cuando los niveles de calcio bajan, la tropomiosina vuelve a su posición inicial y cesa la contracción.
La exposición de los sitios de unión de la actina con la miosina permite que ambas proteínas se unan y que la miosina empuje a la actina hacia el centro del sarcómero, deslizándose sobre la miosina.
Durante la contracción muscular, las líneas Z de cada sarcómero se acercan hacia el centro, aproximándose a la línea M, aumentando la interdigitación entre la actina y miosina y reduciendo el tamaño de las bandas I y H. El grado de acortamiento dependerá de la sumatoria del acortamiento de cada uno de los sarcómeros del musculo contraído.
- Berne, R., & Levy, M. (1990). Physiology. Mosby; International Edition.
- Fox, S. I. (2006). Human Physiology (9th ed.). New York, USA: McGraw-Hill Press.
- Gartner, L., & Hiatt, J. (2002). Texto Atlas de Histología (2nd ed.). México D.F.: McGraw-Hill Interamericana Editores.
- Murray, R., Bender, D., Botham, K., Kennelly, P., Rodwell, V., & Weil, P. (2009). Harper ’s Illustrated Biochemistry (28th ed.). McGraw-Hill Medical.
- Rawn, J. D. (1998). Biochemistry. Burlington, Massachusetts: Neil Patterson Publishers.
- Ross, M., & Pawlina, W. (2006). Histology. A Text and Atlas with correlated cell and molecular biology (5th ed.). Lippincott Williams & Wilkins.
- West, J. (1998). Bases Fisiológicas de la Práctica Médica (12ava ed.). México D.F.: Editorial Médica Panamericana.
