Electroforesis: fundamento, técnica, para qué sirve, ejemplos
La electroforesis es una técnica empleada para separar moléculas en un campo eléctrico. Tiene que ver, concretamente, con la migración de partículas cargadas bajo la influencia de una corriente eléctrica aplicada entre dos polos, uno positivo y otro negativo.
Actualmente la electroforesis es tal vez uno de los procedimientos más rutinarios que tienen lugar durante el desarrollo de un experimento, especialmente en los campos relacionados con la química analítica, la bioquímica y las ciencias biológicas y médicas en general.

Se utiliza para separar proteínas, péptidos, moléculas de ADN, ARN y otras de acuerdo con su carga, tamaño, densidad y pureza.
Las distintas casas comerciales han diseñado diferentes formatos, con diferentes aplicaciones y utilidades apropiadas para fines específicos, sin embargo, todos los procedimientos requieren los mismos elementos básicos:
– Una fuente de energía para generar la carga eléctrica
– Un medio de soporte para que ocurra la separación
– Una solución tampón (buffer) para mantener el pH constante
Índice del artículo
- 1 Fundamento
- 2 Técnica
- 3 ¿Para qué sirve la electroforesis?
- 4 Factores que afectan a la electroforesis
- 5 Ejemplos de uso de la electroforesis
- 6 Referencias
La electroforesis no es más que la migración (separación) de partículas o moléculas cargadas (natural o artificialmente) en un medio o soporte bajo la influencia de un campo eléctrico.
La técnica se fundamenta en una de las ecuaciones físicas principales del electromagnetismo, según la cual la fuerza es igual a la carga eléctrica multiplicada por el campo eléctrico aplicado en ese punto (F (fuerza)= q (carga eléctrica) x E (campo eléctrico)).
De acuerdo con esta ecuación, dos partículas con la misma masa, pero de carga distinta, se moverán a tasas diferentes en el mismo campo eléctrico. Además, la velocidad del movimiento de estas partículas dependerá de la relación entre su carga y su masa.
Los científicos han aprovechado estas propiedades y relaciones carga/masa para separar a los componentes de las biomoléculas en sus partes más pequeñas, así como también para separar distintas moléculas en una mezcla, entre otras aplicaciones.
Es importante recordar que las moléculas biológicas como los aminoácidos, los péptidos, las proteínas, algunos carbohidratos, los nucleótidos y los ácidos nucleicos todos tienen algo que denominamos “grupos ionizables”, por lo que pueden existir como especies cargadas positiva o negativamente en determinadas condiciones de pH.
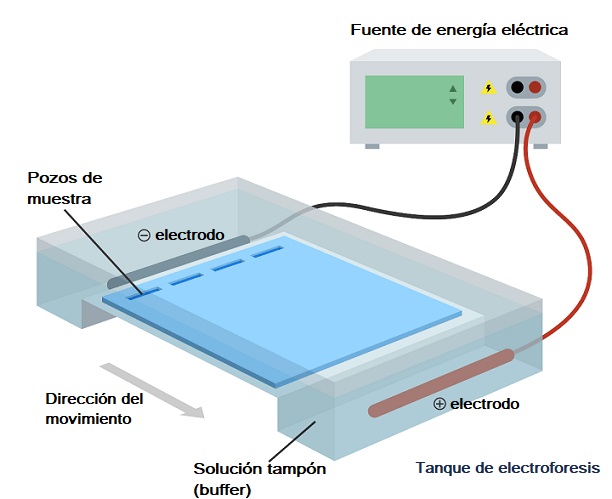
Aunque existen diversos tipos de electroforesis, la electroforesis en gel es la más utilizada en los análisis bioquímicos, de biología molecular y biotecnología, por lo que será de la que hablaremos brevemente en términos técnicos.
Como su nombre lo indica, la electroforesis en gel implica el uso de un medio de soporte sólido en forma de gel, bien sea para el análisis/separación de mezclas de proteínas o de ácidos nucleicos (ADN y/o ARN) bajo la influencia de un campo eléctrico.
El sistema o aparato empleado para realizar una “corrida” electroforética en gel puede ser horizontal (generalmente empleado para ácidos nucleicos) o vertical (generalmente empleado para proteínas).
Los ácidos nucleicos usualmente son separados utilizando geles de agarosa (polisacárido de galactosa) que se prepara con una solución tampón adecuada (Tris/Acetato/EDTA o Tris/Borato/EDTA) y cuya concentración determinará la “resolución” de fragmentos de distintos tamaños.
Preparación de la muestra
El primer paso antes de realizar una corrida electroforética en un gel de agarosa es obtener la muestra. Esto dependerá del fin experimental y las muestras pueden ser el producto de una digestión enzimática, de una reacción en cadena de la polimerasa (PCR), de una purificación de ácidos nucleicos, etc.
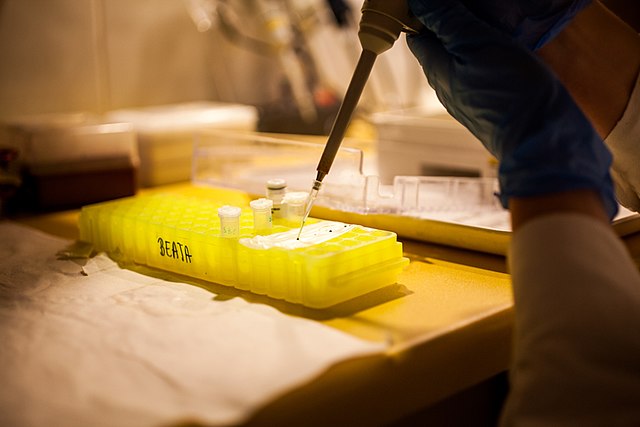
Después de su obtención, esta se mezcla con una solución coloreada (solución de carga) que permite la deposición rápida de la muestra en un pozo, pues tiene glicerol y un tinte que permite seguir la corrida visualmente.
Preparación del gel
Este paso consiste en mezclar la cantidad necesaria del sustrato gelificante (la agarosa) con la solución tampón, fundirlo empleando calor y solidificarlo en un soporte que funciona como “molde”.
Durante la gelificación se introducen unos “peines” en el gel posicionado en el “molde” para delimitar los “pozos” donde se introducirán las muestras antes de la corrida.
Una vez el gel se ha enfriado y solidificado, se remueven los “peines” y este se introduce en un recipiente conocido como “cubeta”, que está lleno con la solución tampón de corrida, (Tris/Acetato/EDTA o Tris/Borato/EDTA).
Esta cubeta está, a su vez, incluida en lo que se denomina la “cámara electroforética”, que no es más que el recipiente por el cual se hace pasar el campo eléctrico y que tiene un espacio donde se introduce el gel y dos secciones que se llenan de solución tampón (buffer de corrida).
Esta cámara tiene dos electrodos, uno positivo y otro negativo entre los cuales se produce el movimiento de iones tras la aplicación de un campo eléctrico (está conectada a una fuente de poder).
Carga de las muestras
Una vez las muestras se han mezclado con la solución de carga respectiva, estas se introducen en los “pozos” hechos previamente en el gel.
Ya que los ácidos nucleicos tienen una carga neta negativa, estos migran desde el polo negativo hacia el positivo, por lo que esto se debe tener en cuenta cuando se conecta la cámara a la fuente de poder, asegurándose que el polo negativo corresponda al sitio más próximo al lugar donde fueron cargadas las muestras.
El tiempo de corrida se establece en estricta dependencia del investigador a cargo del experimento. El voltaje generalmente se calcula en una relación de 5 voltios por cada centímetro de distancia en el gel que separa los dos electrodos.
Visualización
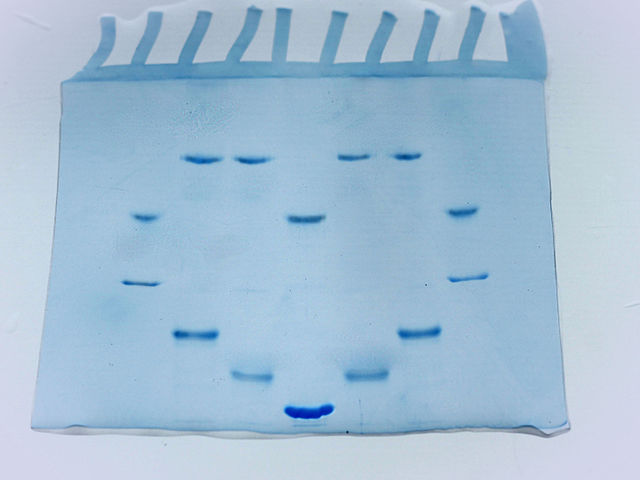
Cuando ha finalizado la corrida el gel (cuando las muestras han recorrido el gel de un extremo al otro) este se sumerge en una solución de bromuro de etidio (EtBr), un tinte que se intercala entre las bases nitrogenadas y que las “marca”, por lo que pueden ser visualizadas en un transiluminador empleando luz ultravioleta.
La electroforesis ha sido empleada históricamente con múltiples propósitos. Hoy en día, sin embargo, su utilidad depende en gran medida de la “pregunta” que se hace el investigador en relación con un fenómeno o un sistema en particular, así como del tipo de electroforesis que desea emplear.
Podemos, no obstante, enlistar algunas de las principales funciones que tiene esta técnica, comenzando por las más “raras” y finalizando por las más populares y mayormente explotadas en el mundo de las ciencias biológicas. La electroforesis es útil:
– Para el análisis cuantitativo de mezclas complejas de macromoléculas y para el cálculo de los potenciales “zeta” (propiedad coloidal de una partícula en un medio líquido bajo la influencia de un campo eléctrico estático).
– Para el análisis de sueros sanguíneos con propósitos de diagnóstico.
– Para la separación de glucoproteínas, lipoproteínas y hemoglobina sanguíneas.
– Para el análisis de alimentos, productos farmacéuticos y contaminantes ambientales.
– Para la separación de los fragmentos de ADN después de su digestión con enzimas de restricción.
– Para la separación de moléculas de ácidos nucleicos antes de su transferencia a membranas para análisis posteriores.
– Para el análisis de los productos de PCR (reacción en cadena de la polimerasa) verificando si ocurrió o no amplificación.
– Para la estimación del tamaño de las moléculas en una mezcla de ADN o ARN.
– Para la estimación de la cantidad y/o la calidad de los ácidos nucleicos purificados.
– Para determinar el tamaño de una proteína.
– Para identificar proteínas.
– Para determinar la pureza de una muestra después de varios pasos de purificación.
– Para identificar la presencia de enlaces disulfuro intramoleculares.
– Para determinar la interacción entre proteínas.
– Para determinar el punto isoeléctrico de una proteína.
La migración de una partícula en un campo eléctrico depende de diversos factores, entre los que destacan:
– Su carga eléctrica
– Su tamaño molecular
– Su hidrofobicidad y su forma
– La magnitud del campo eléctrico que se le aplica
– La temperatura del sistema y la fuerza iónica de la solución tamponadora utilizada
– La naturaleza del medio donde se encuentra
Entre los parámetros relacionados con las partículas (muestra) que son sometidas a un campo eléctrico, los principales factores que afectan este proceso tienen que ver con su carga, su tamaño y su forma.
Mientras mayor es la carga neta de una partícula, mayor será su tasa de migración y dicha magnitud dependerá del pH. Sin embargo, la relación con el tamaño es inversamente proporcional, lo que significa que mientras más “grande” es la molécula, más lentamente migrará.
Hasta ahora hemos hablado de la importancia del campo eléctrico para conseguir el movimiento de una partícula por electroforesis, pero no hemos definido qué es: fuerza eléctrica por unidad de carga o, en términos más simples, una región del espacio donde existe una fuerza eléctrica.
Los parámetros concernientes al campo eléctrico que pueden afectar la migración son el voltaje, la corriente y la resistencia.
El voltaje afecta el “tiempo de vuelo” de las moléculas que son separadas tras aplicar el campo eléctrico. Mientras más alto es, más rápido se mueven estas.
La corriente (flujo continuo y uniforme de electrones que son “empujados” por la fuente de voltaje) es conducida entre los electrodos del sistema electroforético gracias a los iones presentes en la solución tamponadora. Está directamente relacionada con el voltaje.
La composición, la fuerza iónica y el pH de la solución tampón son los principales parámetros que afectan una “corrida” electroforética, pues influyen directamente sobre algunas de las propiedades de las muestras, especialmente la carga eléctrica.
¿Por qué? La solución tampón estabiliza el pH del medio de soporte donde ocurre la electroforesis. Su composición puede afectar el desplazamiento de las partículas que migran y la concentración iónica también, pues está directamente relacionada con la corriente.
Los distintos tipos y formatos de electroforesis presentan, además, distintos medios de soporte sobre los cuales ocurre la migración y donde puede ser posteriormente “registrada”.
La tasa de migración de las moléculas sometidas a electroforesis depende del tipo de medio de soporte, que usualmente debe ser inerte.
Son importantes sus características de absorción, de electroendo-ósmosis (capacidad de movimiento de un líquido a través de una membrana bajo la influencia de un campo eléctrico) y su capacidad de tamizado molecular.
Ejemplos clásicos de técnicas electroforéticas empleadas en biología y biotecnología incluyen:
– Electroforesis en geles de agarosa (del inglés Agarose Gel Electrophoresis)
– Electroforesis en geles de acrilamida en condiciones desnaturalizantes (SDS-PAGE, del inglés Sodium Dodecyl Sulphate Polyacrylamide Gel Electrophoresis)
– Electroforesis en geles de acrilamida en condiciones nativas (BN-PAGE, del inglés Blue Native Polyacrylamide Gel Electrophoresis)
– Electroforesis en dos dimensiones (2D-PAGE, del inglés Two-dimensional Polyacrylamide Gel Electrophoresis)
– Electroforesis capilar (del inglés Capilar Electrophoresis)
– Isoelectroenfoque (del inglés Isoelectrofocusing)
– Electroforesis de campo pulsado (del inglés Pulsed Field Electrophoresis)
- Beck, Kevin. (2020, May 25). The Types of Electrophoresis. Sciencing.com. Retrieved from sciencing.com
- Essays, UK. (November 2018). Electrophoresis Types and Applications. Retrieved from ukessays.com
- Nelson, D. L., Lehninger, A. L., & Cox, M. M. (2008). Lehninger principles of biochemistry. Macmillan.
- Parmar, P. (August 2018). Electrophoresis: Meaning, Definition and Classification (With Diagram). Bio Technology. Retrieved from biotechnologynotes.com
- Perrett, D. (2010). 200 years of Electrophoresis. Chromatog. Today, 4-7.
- Righetti, P. G. (2005). Electrophoresis: the march of pennies, the march of dimes. Journal of Chromatography A, 1079(1-2), 24-40.
- Rilbe, H. (1995). Some reminiscences of the history of electrophoresis. Electrophoresis, 16(1), 1354-1359.
- Vesterberg, O. (1993). A short history of electrophoretic methods. Electrophoresis, 14(1), 1243-1249.
- Vinayagam, M. (No Date). Factors affecting electrophoresis. Academia.edu. Retrieved from academia.edu
