Tinción de Kinyoun: fundamento y técnicas
La tinción Kinyoun es una técnica de coloración utilizada para teñir bacterias y parásitos ácido alcohol resistentes. Nació de la modificación de la coloración de Ziehl-Neelsen; ambas técnicas se interpretan de la misma manera pero se diferencian en dos elementos: en la preparación del reactivo principal y en que la técnica de Kinyoun no utiliza calor.
Por esta razón también es conocida como Ziehl-Neelsen modificada en frío o tinción en frío de Kinyoun. Esta indicada para la coloración de Micobacterium tuberculosis, Micobacterium leprae, micobacterias atípicas, Nocardias sp, Criptosporidium parvum, Criptosporidium meleagridis, Criptosporidium felis, Criptosporidium muris y Cyclosporas cayetanensis.
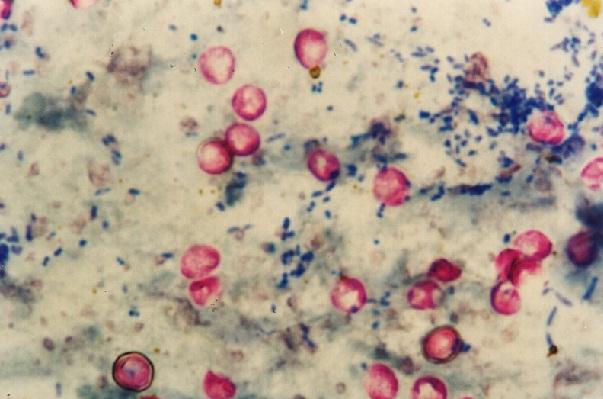
Vale acotar que las Nocardias se tiñen débilmente con esta técnica dado que son parcialmente ácido alcohol resistentes, por lo que para este género existe una modificación de la metodología.
A su vez, se ha combinado la técnica de Kinyoun al frío con la técnica tricrómica modificada por Didier para la detección de coccidios (Criptosporidium parvum e Isospora belli) y esporas de microsporidios (Enterocytozoon bieneusi y Encephalitozoon intestinalis).
Índice del artículo
- 1 Fundamento
- 2 Técnica
- 2.1 Materiales
- 2.2 Preparación de la fucsina fenicada de Kinyoun
- 2.3 Preparación del alcohol-ácido
- 2.4 Preparación del colorante de contraste azul de metileno
- 2.5 Técnica de la tinción de kinyoun
- 2.6 Técnica de Kinyoun especial para Nocardias
- 2.7 Técnica combinada de fucsina fenicada y tricrómica modificada por Didier
- 2.8 Control de calidad
- 3 Técnica de Kinyoun en comparación con la técnica de Ziehl -Neelsen
- 4 Referencia
El reactivo principal de la tinción es la carbolfucsina o fucsina fenicada, que tiene la propiedad de unirse a los ácidos carbólicos existentes dentro de la pared celular cérea, rica en lípidos (ácidos micólicos) de las micobacterias y ciertos parásitos.
Esa unión no es contrarrestada por el decolorante ácido; por ello, los microorganismos se definen como ácido alcohol resistentes.
A diferencia de la técnica de Ziehl-Neelsen —que fija el colorante a través del calor—, en la técnica de Kinyoun este paso no es necesario, ya que la solución de fucsina fenicada que se prepara para esta técnica contiene alta concentración de fenol.
El fenol disuelve el material lipídico de la pared celular, lo que permite la entrada del colorante carbolfucsina. Después de que el colorante penetra, se queda fijo a pesar del lavado con el alcohol-ácido.
De esta manera los microorganismos ácido alcohol resistentes toman el característico color rojo, mientras que todo lo que no es ácido alcohol resistente se decolora y se tiñe de azul.
– Fucsina fenicada modificada.
– Alcohol –ácido.
– Azul de metileno.
– Fucsina básica: 4 gr.
– Fenol: 8 ml.
– Alcohol (95 %): 20 ml.
– Agua destilada: 100 ml.
Se debe disolver lentamente la fucsina básica en el alcohol, mezclando constantemente. Posteriormente se funde el fenol cristalizado en un baño María a 56 °C. Una vez disuelto, se agregan 8 ml a la solución de fucsina preparada anteriormente.
– Ácido clorhídrico concentrado: 3 ml.
– Etanol (95 %): 97 ml.
Se debe medir, unir y mezclar.
– Azul de metileno: 0.3 g.
– Agua destilada: 100 ml.
Se pesa y se disuelve.
1- Preparar un frotis directamente de la muestra, que puede ser esputo, fluido pulmonar, sedimento de orina, líquido cefalorraquídeo o heces, entre otros; o a partir de una suspensión de microorganismos obtenidos de colonias puras desarrolladas en medios de cultivos primarios.
2- Fijar el frotis con calor.
3- Colocar el frotis sobre el puente de coloración y cubrir con el reactivo de fucsina fenicada de Kinyoun preparado. Se deja reposar durante 3 o 5 minutos.
4- Lavar con agua destilada.
5- Decolorar con alcohol ácido durante 3 minutos y lavar nuevamente con agua destilada.
6- Decolorar nuevamente con alcohol ácido durante 1 o 2 minutos hasta que no arrastre más colorante.
7- Lavar con agua destilada y dejar escurrir, colocando el portaobjetos en posición vertical.
8- Cubrir la preparación con azul de metileno y dejar actuar por 4 minutos.
9- Lavar con agua destilada y dejar secar al aire.
10- Examinar a 40X y luego a 100X.
Si quiere mejorarse y acelerarse la tinción de los microorganismos ácido alcohol resistentes, se agrega 1 gota de un agente humectante (como el tergitol N° 7) a 30 o 40 ml de fucsina fenicada de Kinyoun.
Algunos laboratorios cambian el colorante de contraste azul de metileno por verde brillante o ácido pícrico; el primero otorga un color verde al fondo y el segundo genera un color amarillo.
Para mejorar la tinción de las bacterias del género Nocardia se usa una modificación de la tinción de Kinyoun. La técnica es la siguiente:
1- Cubrir el frotis con fucsina fenicada de Kinyoun por 3 minutos.
2- Lavar con agua destilada.
3- Decolorar brevemente con alcohol ácido preparado al 3 % hasta que no arrastre más colorante.
4- Lavar nuevamente con agua destilada.
5- Cubrir la preparación con azul de metileno y dejar actuar por 30 segundos.
6- Lavar con agua destilada y dejar secar al aire.
Esta técnica se recomienda para el análisis de muestras de heces en busca de coccidios y esporas de Microsporidium sp al mismo tiempo. El procedimiento a seguir es el siguiente:
1- Cubrir el frotis con fucsina fenicada de Kinyoun durante 10 minutos.
2- Retirar el colorante y lavar con agua destilada.
3- Decolorar por 30 segundos con alcohol ácido clorhídrico.
4- Lavar nuevamente con agua destilada.
5- Cubrir el frotis con solución tricrómica por 30 minutos a 37 °C.
6- Lavar con agua destilada.
7- Decolorar por 10 segundos con alcohol ácido acético.
8- Lavar el frotis durante 30 segundos usando etanol al 95 %.
Como control positivo se preparan frotis con cepas de Micobacterium tuberculosis y se tiñen con los reactivos preparados para verificar que las bacterias tomen el color adecuado (rojo-fucsia).
También se pueden usar controles negativos preparando frotis con cualquier cepa que no sea ácido alcohol resistente, verificando así que toda la muestra tome el color de contraste.
La técnica de Kinyoun es más sencilla dado que elimina el paso del calentamiento, pero su ventaja principal es que evita la emisión de vapores, altamente tóxicos y causantes de cáncer a largo plazo. Por tanto, la tinción de Kinyoun es más segura para el personal encargado de realizar las tinciones.
Es importante tomar en cuenta que hay que tener la precaución de que los reactivos no entren en contacto directo con la piel, pues son corrosivos y el decolorante es inflamable.
En cuanto a las desventajas, un frotis negativo no indica necesariamente que el microorganismo no esté presente. Además, la presencia de detritus celulares puede originar falsos positivos, lo que genera confusión en el diagnóstico.
- Química Clínica Aplicada. (2016). BK Kinyoun Kit. Disponible en: cromakit.es
- Orozco-Rico Miguel. Tinción Kinyoun y dos Coccidios en VIH. Revista Médica MD. 2011; 3 (2):137
- Forbes B, Sahm D, Weissfeld A (2009). Diagnóstico Microbiológico de Bailey & Scott. 12 ed. Argentina. Editorial Panamericana S.A.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnóstico Microbiológico. (5ta ed.). Argentina, Editorial Panamericana S.A.
- Wikipedia contributors. “Kinyoun stain.” Wikipedia, The Free Encyclopedia. Wikipedia, The Free Encyclopedia, 8 Feb. 2018. Web. 5 Jan. 2019.
- Combol A, Fernández N, Figueredo E, Acuña A, Zanetta E. Implementación de una técnica de coloración para el diagnóstico simultáneo de Coccidios y Microsporidios. Instituto de Higiene de la Universidad de la República. Montevideo. Uruguay. Disponible en: higiene.edu.uy
