Tinción de Ziehl-Neelsen: fundamento, reactivos y técnica
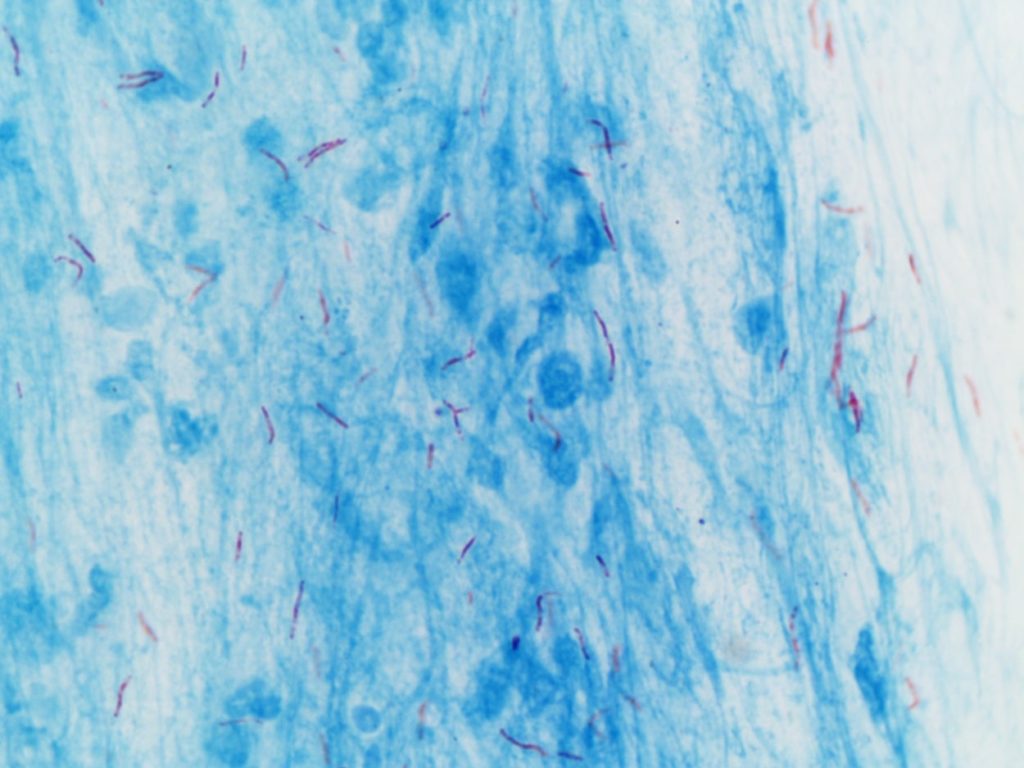
¿Qué es la tinción de Ziehl-Neelsen?
La tinción de Ziehl-Neelsen en una técnica de coloración para identificar microorganismos alcohol-ácido resistentes (AAR). El nombre de este procedimiento de microbiología hace referencia a sus autores: el bacteriólogo Franz Ziehl y el patólogo Friedrich Neelsen.
Esta técnica es un tipo de coloración diferencial, lo que implica el uso de distintos colorantes con la finalidad de crear contraste entre las estructuras que se desean observar, diferenciar y posteriormente identificar. La tinción de Ziehl-Neelsen sirve para identificar ciertos tipos de microorganismos.
Algunos de estos microorganismos son micobacterias (por ejemplo, Mycobacterium tuberculosis), nocardias (por ejemplo, Nocardia sp.) y algunos parásitos unicelulares (por ejemplo, Cryptosporidium parvum). Muchas de las bacterias pueden clasificarse a través de una técnica común llamada tinción de Gram.
No obstante, algunos grupos bacterianos requieren otros métodos para poder identificarlos. Técnicas como la tinción de Ziehl-Neelsen requieren combinaciones de colorantes con calor para fijar el primero a la pared celular.
Luego viene un proceso de decoloración que permite obtener dos resultados: resistencia o sensibilidad a la decoloración por ácidos y alcoholes.
Fundamento
El fundamento de esta técnica de tinción se basa en las propiedades de la pared celular de estos microorganismos. La pared está formada por un tipo de ácidos grasos llamados ácidos micólicos; estos se caracterizan por presentar cadenas muy largas.
Cuando los ácidos grasos presentan estructuras muy largas, estos pueden retener los colorantes con mayor facilidad. Algunos géneros de bacterias son muy difíciles de teñir mediante tinción de Gram, debido al alto contenido de ácidos micólicos de la pared celular.
En la tinción de Ziehl-Neelsen se utiliza el compuesto fenólico carbol fucsina, un colorante básico. Este tiene la capacidad de interactuar con los ácidos grasos de la pared celular, la cual es de textura cerosa a temperatura ambiente.
La tinción con carbol fucsina es mejorada en presencia de calor, debido a que la cera se derrite y las moléculas de colorante se mueven con mayor rapidez hacia el interior de la pared celular.
El ácido que se usa posteriormente sirve para decolorar las células que no fueron teñidas porque su pared no era lo suficientemente afín al colorante; por lo tanto, la fuerza del decolorante ácido es capaz de eliminar el colorante ácido. Las células que resisten esta decoloración se llaman ácido-resistentes.
Colorante secundario
Después de la decoloración de la muestra, esta se contrasta con otro colorante llamado colorante secundario. Generalmente se utiliza el azul de metileno o el verde de malaquita.
El colorante secundario tiñe el material de fondo y, en consecuencia, crea contraste a las estructuras que fueron teñidas en el primer paso. Solo las células decoloradas absorben el segundo colorante (contra-tinción) y toman su color, mientras que las células ácido-resistentes conservan el color rojo.
Este procedimiento se usa frecuentemente para la identificación de Mycobacterium tuberculosis y Mycobacterium leprae, las cuales son llamadas bacilos ácido-alcohol resistentes.
Reactivos
Colorante primario
Se usa carbol fucsina al 0,3 % (filtrado). Este colorante se prepara a partir de una mezcla de alcoholes: fenol en etanol (90 %) o metanol (95 %), y en esta mezcla se disuelven 3 gramos de fucsina básica.
Solución decolorante
En este paso se pueden emplear soluciones de ácido alcohol al 3 % o ácido sulfúrico al 25 %.
Colorante secundario (contra-colorante)
El colorante más empleado para realizar el contraste en las muestras suele ser el azul de metileno al 0,3 %. Sin embargo, también se pueden emplear otros, como el verde malaquita al 0,5 %.
Técnica
Procedimiento de tinción ácido-rápida
Preparar un frotis bacteriano
Esta preparación se hace en un portaobjetos limpio y seco, siguiendo las precauciones de esterilidad.
Secado del frotis
Dejar que el frotis se seque a temperatura ambiente.
Calentar la muestra
La muestra se debe calentar aplicando fuego al portaobjeto por debajo. Se puede hacer una fijación con alcohol cuando el frotis no se ha preparado con esputo (tratado con hipoclorito de sodio para blanquearlo) y si no se va a teñir inmediatamente.
M. tuberculosis se elimina con lejía y durante el proceso de tinción. La termofijación del esputo no tratado no matará a M. tuberculosis, mientras que la fijación con alcohol es bactericida.
Cubrir la mancha
La mancha se cubre con la solución de carbol fucsina (colorante básico primario).
Calentar la mancha
Esto se hace durante 5 minutos. Debe notar un desprendimiento de vapor (aproximadamente a 60 °C). Es importante no sobrecalentar y evitar quemar la muestra.
Con relación al calentamiento de la mancha, se debe tener mucho cuidado al calentar la carbol fucsina, especialmente si la tinción se lleva a cabo sobre una bandeja u otro recipiente en el que se hayan recogido productos químicos altamente inflamables de la tinción previa.
Solo se debe aplicar una pequeña llama debajo de los portaobjetos usando un hisopo encendido previamente humedecido con unas gotas de alcohol ácido, metanol o etanol al 70 %. Evitar usar un hisopo grande empapado en etanol porque esto es un riesgo de incendio.
Lavar la mancha
Este lavado debe hacerse con agua limpia. Si el agua del grifo no está limpia, lavar el frotis con agua filtrada o destilada, preferiblemente.
Cubrir el frotis con alcohol ácido
Este alcohol ácido debe estar al 3 %. La cobertura se lleva a cabo durante 5 minutos o hasta que el frotis esté lo suficientemente decolorado, es decir, de color rosa pálido.
Hay que tomar en cuenta que el alcohol ácido es inflamable; por lo tanto, debe usarse con mucho cuidado. Se debe evitar estar cerca de fuentes de ignición.
Lavar la mancha
El lavado debe ser con agua limpia, destilada.
Cubrir el frotis con colorante
Puede ser colorante verde de malaquita (0,5 %) o azul de metileno (0,3 %) durante 1 o 2 minutos, utilizando el tiempo más prolongado si el frotis es delgado.
Lavar la mancha
Nuevamente debe utilizarse agua limpia (destilada).
Drenar
Se debe limpiar la parte posterior del portaobjeto y colocar la mancha en un estante de drenaje, para que esta se seque al aire (no usar papel absorbente para el secado).
Examinar el frotis en el microscopio
Debe usarse el objetivo de 100X y el aceite de inmersión. Escanear el frotis sistemáticamente y anotar las observaciones pertinentes.
Interpretar los resultados
Teóricamente, los microorganismos que se tiñan de un color rojizo se consideran ácido alcohol resistente positivos (AAR+).
Al contrario, si los microorganismos se tiñen de azul o verde, dependiendo del colorante utilizado como contra-colorante, se consideran ácido alcohol resistente negativos (AAR-).
Referencias
- Apurba, S. & Sandhya, B. (2016). Essentials of Practical Microbiology (1st ed.). Jaypee Brothers Medical Publishers.
- Bauman, R. (2014). Microbiology with Diseases by Body System (4th ed.). Pearson Education, Inc.
- Heritage, J., Evans, E. & Killington, A. (1996). Introductory Microbiology (1st ed.). Cambridge University Press.
- Morello, J., Granato, P. Wilson, M. & Morton, V. (2006). Laboratory Manual and Workbook in Microbiology: Applications to Patient Care (11th ed.). McGraw-Hill Education.
- Vasanthakumari, R. (2007). Textbook of Microbiology (1st ed.). B.I. Publications PVT.
