Ácido cianhídrico: estructura molecular, propiedades, usos
El ácido cianhídrico o cianuro de hidrógeno es un compuesto orgánico cuya fórmula química es HCN. También se le conoce como metanonitrilo o formonitrilo y, hasta hace varios años, como ácido prúsico, aunque este en realidad es otro compuesto.
El ácido cianhídrico es un gas incoloro, extremadamente venenoso, que se obtiene al tratar cianuros con ácidos. Este ácido se encuentra dentro de la semilla de los duraznos, conocido en muchos sitios también como melocotón.

A una temperatura ambiente menor de 25 ºC es un líquido y por encima de esa temperatura es un gas. En ambos casos es extremadamente tóxico para el ser humano, animales e incluso la mayoría de microorganismos no aclimatados a él. Es un buen disolvente para iones. Es muy inestable pues tiende a polimerizar fácilmente.
Se encuentra en el reino vegetal incorporado en las moléculas de algunos glucósidos, pues cuando estos son hidrolizados por enzimas propias del vegetal se obtiene el HCN, glucosa y benzaldehído.
Estos glucósidos están dentro de las semillas de ciertas frutas como duraznos, albaricoques, cerezas, ciruelas y en las almendras amargas, por lo que nunca deben ingerirse.
También se encuentra en glucósidos de plantas como algunos tipos de sorgo. Además, algunas bacterias lo producen durante su metabolismo. Se emplea mayormente en la producción de polímeros y en algunos procesos metalúrgicos.
El HCN es un veneno letal por inhalación, ingestión y contacto. Está presente en el humo del cigarrillo y en el humo del incendio de plásticos y materiales que contienen carbono y nitrógeno. Se considera un contaminante atmosférico por producirse durante la combustión de material orgánico de zonas extensas del planeta.
Índice del artículo
- 1 Estructura molecular y configuración electrónica
- 2 Nomenclatura
- 3 Propiedades
- 4 Ubicación en la naturaleza
- 5 Usos
- 6 Riesgos
- 7 Referencias
El ácido cianhídrico o cianuro de hidrógeno es un compuesto covalente, molecular, con un átomo de hidrógeno, uno de carbono y uno de nitrógeno.
El átomo de carbono y el de nitrógeno comparten 3 pares de electrones, por lo que forman un enlace triple. El hidrógeno está unido al carbono, el cual con esta unión presenta su valencia de cuatro y su octeto de electrones completo.
El nitrógeno presenta una valencia de cinco y para completar su octeto posee un par de electrones desapareados o solitarios ubicados de forma lateral.
El HCN es por lo tanto una molécula completamente lineal, con un par de electrones desapareados ubicados lateralmente en el nitrógeno.
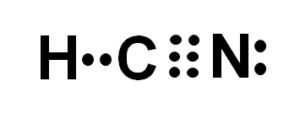
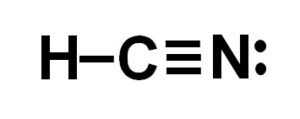
– Ácido cianhídrico
– Cianuro de hidrógeno
– Metanonitrilo
– Formonitrilo
– Ácido hidrociánico
Por debajo de 25,6 ºC, si está anhidro y estabilizado, es un líquido incoloro o azul pálido muy inestable y tóxico. Si está por encima de esa temperatura es un gas incoloro extremadamente venenoso.
27,03 g/mol
-13,28 ºC
25,63 ºC (nótese que hierve apenas por encima de la temperatura ambiente).
-18 ºC (método de copa cerrada)
538 ºC
0,6875 g/cm3 a 20 ºC
Totalmente miscible con agua, alcohol etílico y éter etílico.
K = 2,1 x 10-9
pKa = 9,2 (es un ácido muy débil)
El HCN posee una constante dieléctrica muy elevada (107 a 25 ºC). Esto se debe a que sus moléculas son muy polares y se asocian mediante puentes de hidrógeno, como en el caso del agua H2O.
Por poseer una constante dieléctrica tan alta el HCN resulta ser un buen disolvente ionizante.
El HCN anhidro líquido es muy inestable, tiende a polimerizar violentamente. Para evitar esto se le añaden estabilizantes, como un pequeño porcentaje de H2SO4.
En solución acuosa y en presencia de amoníaco y alta presión forma adenina, compuesto que forma parte del ADN y ARN, es decir, una molécula biológicamente importante.
Es un ácido muy débil, pues su constante de ionización es muy pequeña, por lo que se ioniza solo parcialmente en agua dando el anión cianuro CN–. Forma sales con las bases pero no con los carbonatos.
Sus soluciones acuosas no protegidas de la luz se descomponen lentamente generando formiato de amonio HCOONH4.
En solución presenta un olor débil a almendras.
Por ser un ácido débil generalmente no es corrosivo.
Sin embargo, las soluciones acuosas de HCN que contienen ácido sulfúrico como estabilizante atacan fuertemente el acero a temperaturas mayores de 40 ºC y el acero inoxidable a temperaturas mayores de 80 ºC.
Además las soluciones acuosas diluidas de HCN pueden causar estrés al acero al carbono aún a temperatura ambiente.
También puede atacar algunos tipos de gomas, plásticos y recubrimientos.
Se encuentra relativamente abundante en el reino vegetal formando parte de glucósidos.
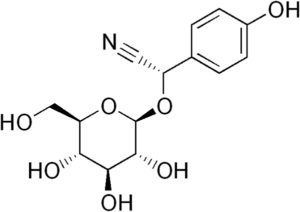
Por ejemplo, se genera a partir de la amigdalina C6H5-CH(-CN)-O-Glucosa-O-Glucosa, compuesto presente en las almendras amargas. La amigdalina es un beta-glucósido cianogénico, pues al hidrolizarse forma dos moléculas de glucosa, una de benzaldehído y una de HCN. La enzima que los libera es la beta-glucoxidasa.
La amigdalina se puede encontrar presente en las semillas de duraznos, albaricoques, almendras amargas, cerezas y ciruelas.
Algunos tipos de plantas de sorgo contienen el glucósido cianogénico denominado durrina (es decir, el p-hidroxi-(S)-mandelonitrilo-beta-D-glucósido). Este compuesto puede degradarse mediante una hidrólisis enzimática de dos pasos.
En primer lugar la enzima durrinasa que es endógena en las plantas de sorgo lo hidroliza a glucosa y p-hidroxi-(S)-mandelonitrilo. Luego, este último se convierte rápidamente en HCN libre y p-hidroxibenzaldehido.

El HCN es el responsable de la resistencia de las plantas de sorgo hacia plagas y patógenos.
Esto se explica por el hecho de que la durrina y la enzima durrinasa tienen diferentes ubicaciones en estas plantas, y entran en contacto solo cuando los tejidos son lesionados o destruidos, liberando el HCN y protegiendo la planta de infecciones que pudiesen penetran por la parte lesionada.
Adicionalmente, algunas bacterias patógenas del ser humano como la Pseudomonas aeruginosa y P. gingivalis lo producen durante su actividad metabólica.
El uso que involucra la mayor parte del HCN producido a nivel industrial es la preparación de intermediarios para síntesis orgánica.
Se emplea en la síntesis de adiponitrilo NC-(CH2)4-CN, el cual se utiliza para preparar el nylon o nailon, una poliamida. También sirve para preparar acrilonitrilo o cianoetileno CH2=CH-CN, usado para preparar fibras acrílicas y plásticos.
Su derivado el cianuro de sodio NaCN se utiliza para la recuperación de oro en la minería de este metal.
Otro de sus derivados el cloruro de cianógeno ClCN sirve para fórmulas pesticidas.
El HCN se emplea para la preparación de agentes quelantes como el EDTA (etilen-diamino-tetra-acetato).
Sirve para la manufactura de ferrocianuros y algunos productos farmacéuticos.
El gas HCN se ha empleado como insecticida, fungicida y desinfectante, para fumigación de barcos y edificios. También para fumigar muebles con el objeto de restaurarlos.
El HCN se ha utilizado en pulido de metales, en electrodeposición de metales, procesos fotográficos y procesos metalúrgicos.
Por su altísima toxicidad fue designado como agente de guerra química.
Se ha usado como herbicida y plaguicida en huertos. Tuvo uso para controlar escamas y otros patógenos de los árboles de cítricos, pero algunas de estas plagas se han vuelto resistentes al HCN.
También se ha empleado para fumigar silos de granos. El HCN gaseoso preparado en el sitio ha sido utilizado en la fumigación de granos de trigo para preservarlos de plagas como insectos, hongos y roedores. Para este uso es esencial que las semillas a fumigar toleren al agente plaguicida.
Se han hecho pruebas fumigando semillas de trigo con HCN y se ha encontrado que no afecta negativamente el potencial de germinación de estas, más bien parece favorecerlo.
Sin embargo, altas dosis de HCN pueden reducir significativamente la longitud de las pequeñas hojas que brotan de la semilla.
Por otra parte, debido al hecho de que es un potente nematicida y que algunas plantas de sorgo lo poseen en sus tejidos, se está investigando el potencial de las plantas de sorgo para ser usadas como abono verde biocida.
Su utilización serviría para el mejoramiento de suelos, suprimir malezas y controlar enfermedades y daños que causan los nematodos fitoparasitarios.
Para el ser humano el HCN es un veneno letal por todas las rutas: inhalación, ingestión y contacto.

Inhalado puede ser letal. Se estima que cerca del 60-70% de la población puede detectar el olor a almendras amargas del HCN cuando este se encuentra en aire a una concentración de 1-5 ppm.
Pero hay un 20% de la población que no puede detectarlo aún a concentraciones letales por estar genéticamente imposibilitados para hacerlo.
Ingerido es un veneno agudo y de acción inmediata.
Si sus soluciones entran en contacto con la piel, el cianuro asociado puede ser letal.
El HCN está presente en el humo del cigarrillo y el que se genera cuando se queman plásticos que contienen nitrógeno.
Es un asfixiante químico y es rápidamente tóxico, conduciendo frecuentemente a la muerte. Al entrar al organismo se une a las metaloenzimas (enzimas que contienen un ion metálico) inactivándolas. Es un agente tóxico para varios órganos del cuerpo humano
Su principal efecto tóxico consiste en la inhibición de la respiración celular, pues desactiva una enzima que influye en la fosforilación en las mitocondrias, las cuales son organelos que intervienen, entre otras cosas, en la función respiratoria de las células.
El HCN está presente en el humo de cigarrillo.
A pesar de que mucha gente sabe el efecto de envenenamiento del HCN, pocas personas se dan cuenta de que están expuestas a su efecto dañino a través del humo del cigarrillo.
El HCN es uno de los causantes de la inhibición de varias enzimas respiratorias celulares. La cantidad de HCN presente en el humo de cigarrillo tiene efecto dañino particularmente en el sistema nervioso.
Se han reportado niveles de HCN en humo de cigarrillo de entre 10 y 400 μg por cigarrillo para el humo inhalado directamente y de 0,006 a 0,27 μg/cigarrillo para inhalación secundaria (fumador pasivo). El HCN produce efectos tóxicos desde 40 μM en adelante.

Al ser inhalado rápidamente entra al torrente sanguíneo, donde queda en libertad en el plasma o se une a la hemoglobina. Una pequeña parte se convierte a tiocianato y es excretado por la orina.
La exposición prolongada al calor del HCN líquido en recipientes cerrados puede causar ruptura violenta e inesperada de estos. Puede polimerizar explosivamente a 50-60 ºC en presencia de trazas de álcali y en ausencia de inhibidores.
El HCN se libera durante la combustión de polímeros que contienen nitrógeno, como lana, seda, poliacrilonitrilos y nylon, entre otros. Estos materiales están presentes en nuestros hogares y en la mayoría de sitios de la actividad humana.
Por esta razón durante los incendios el HCN puede potencialmente ser la causa de muerte por inhalación.
El HCN es un contaminante de la tropósfera. Es resistente a la fotólisis y bajo las condiciones ambientales de la atmósfera no sufre hidrólisis.
Los radicales hidroxilo OH• producidos fotoquímicamente pueden reaccionar con el HCN, pero la reacción es muy lenta, por lo que la vida media del HCN en la atmósfera es de 2 años.
Cuando se quema biomasa, especialmente turba, el HCN es liberado a la atmósfera, y también durante las actividades industriales. Sin embargo, la combustión de turba es 5 a 10 veces más contaminante que la quema de otro tipo de biomasa.
Algunos investigadores han encontrado que las altas temperaturas y la sequía causadas por el fenómeno de El Niño en ciertas zonas del planeta exacerban los incendios estacionales de zonas con alto contenido de materia vegetal descompuesta.

Esto conduce a un quemado intenso de biomasa en las estaciones secas.
Estos eventos son la fuente de altas concentraciones de HCN en la tropósfera, que eventualmente son transportadas a la baja estratósfera, permaneciendo por un tiempo muy largo.
- Cotton, F. Albert and Wilkinson, Geoffrey. (1980). Advanced Inorganic Chemistry. Fourth Edition. John Wiley & Sons.
- U.S. National Library of Medicine. (2019). Hydrogen Cyanide. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Gidlow, D. (2017). Hydrogen cyanide-an update. Occupational Medicine 2017; 67:662-663. Recuperado de ncbi.nlm.nih.gov.
- Van Nostrand’s Scientific Encyclopedia. (2005). Hydrogen Cyanide. 9th Recuperado de onlinelibrary.wiley.com.
- Ren, Y.-L. et al. (1996). Effect of Hydrogen Cyanide and Carbonyl Sulphide on the Germination and Plumule Vigour of Wheat. Pestic. Sci. 1996, 47, 1-5. Recuperado de onlinelibrary.wiley.com.
- De Nicola, G.R. et al. (2011). A Simple Analytical Method for Dhurrin Content Evaluation in Cyanogenic Plants for Their Utilization in Fodder and Biofumigation. J. Agric. Food Chem. 2011, 59, 8065-8069. Recuperado de pubs.acs.org.
- Sheese, P.E. et al. (2017). A global enhancement of hydrogen cyanide in the lower stratosphere throughout 2016. Geophys. Res. Lett., 44, 5791-5797. Recuperado de agupubs.onlinelibrary.wiley.com.
- Surleva, A.R. and Drochioiu, G. (2013). Visualizing Smoking Hazard: A Simple Spectrophotometric Determination of Hydrogen Cyanide in Cigarette Smoke and Filters. J. Chem. Educ. 2013, 90, 1654-1657. Recuperado de pubs.acs.org.
- Alarie, Y. et al. (1990). Role of Hydrogen Cyanide in Human Deaths in Fire. In Fire and Polymers. Chapter 3. ACS Symposium Series. Recuperado de pubs.acs.org.
