Coulombimetría: fundamentos, tipos, aplicaciones
La coulombimetría es una técnica de análisis electroquímico que consiste en llevar a cabo una electrólisis exhaustiva, de tal modo que pueda cuantificarse el analito; es decir, determinar la concentración del analito en las muestras problemas mediante su completa oxidación o reducción. Se trata, a diferencia de la potenciometría, de una técnica dinámica, pues se permite que la corriente fluya libremente por las celdas electroquímicas.
Como su nombre sugiere, la carga eléctrica Q, en unidades de coulomb, C, se mide y correlaciona con la concentración del analito oxidado o reducido en las periferias de los electrodos. Por lo tanto, los estados de oxidación del analito cambian, ocurriendo en el proceso una transferencia y absorción de los electrones que permite el cálculo estequiométrico de la concentración deseada.

En la coulombimetría se utiliza una batería o un potenciostato para controlar la corriente o el potencial aplicados a las celdas. Estas celdas, a diferencia de las potenciométricas, constan de un sistema de tres electrodos, y están equipadas además de un voltímetro y un amperímetro.
La coulombimetría presenta la ventaja de poder realizarse titulaciones sin necesidad de preparar o estandarizar patrones. Asimismo, permite cuantificar cantidades muy pequeñas y limitadas de analito, tales como cationes metálicos, compuestos inorgánicos y compuestos orgánicos. Por ejemplo, existe un coulómetro diseñado exclusivamente para medir el CO2 disuelto en muestras procedentes del océano.
Esta técnica ofrece una ruta analítica diferente a la volumétrica y la potenciométrica, por lo que muchos análisis, dependiendo de la naturaleza electroquímica del analito, pueden desarrollarse coulombimétricamente.
Fundamentos teóricos de la coulombimetría
Ley de Faraday
La coulombimetría se fundamenta en la ley de Faraday, la cual establece una relación entre la carga eléctrica de una celda electroquímica y la cantidad de analito que se está oxidando o reduciendo. Conociendo esta carga Q, así como la carga de un electrón (1.6·10-19 C), se puede calcular el número de electrones involucrado en una reacción, ne-:
ne- = Q/e
Por otro lado, se sabe que un mol de electrones (6.02·1023) porta una carga eléctrica igual a 96485 C, cifra que se conoce como constante de Faraday:
F= eNA
=96485.3365 C/mol
Siendo conveniente expresar la cantidad de electrones en función de los moles. Gracias a esto se puede recurrir a los coeficientes estequiométricos de una reacción electroquímica, séase de oxidación o reducción, tomando en cuenta cuántos moles de electrones ganan o pierden las especies.
Cálculos básicos
Por ejemplo, considérese la siguiente ecuación química:
Ox + 2e– → Red
Midiéndose Q cuando toda la especie Ox se haya reducido a Red, podemos calcular los moles de Ox empleando factores de conversión:
xQ · (mol e– /96485.3365 C) · (mol Ox/ 2mol e–) = mol Ox
Es decir, como sabemos la carga eléctrica para un mol de electrones, tendremos cuántos electrones corresponden a la carga xQ. Pero a su vez, cada 2 moles de esos electrones se usan para oxidar 1 mol de Ox.
Este razonamiento origina una fórmula directa, aunque no sea recomendado memorizársela, sino poder deducirla como se hizo arriba:
n = Q/(Fñe-)
Donde ñe- es el número de moles de electrones en la ecuación química.
Siempre que pueda calcularse Q, independientemente del tipo de coulombimetría, podrá determinarse los moles del analito Ox o Red; siempre y cuando, la eficiencia de la corriente sea del 100%. Esto último significa que toda la carga Q debe ser producto de solo una transformación, sin que haya otras especies reduciéndose u oxidándose.
Fundamentos experimentales de la coulombimetría
Celdas
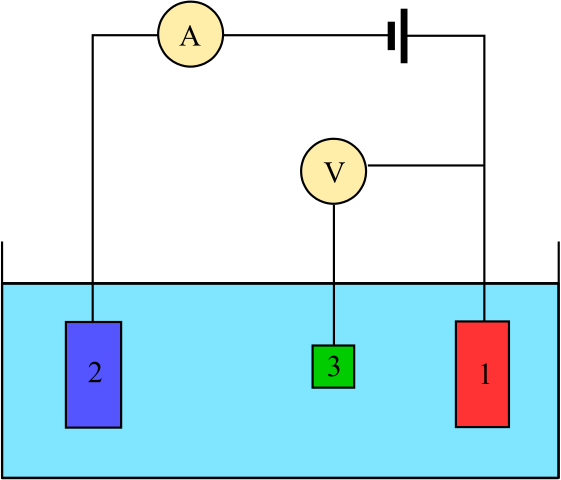
Arriba tenemos un diagrama para una celda con tres electrodos, la cual se utiliza comúnmente en los análisis coulombimétricos. La reacción redox tiene lugar entre los electrodos de trabajo (1) y auxiliar (2). Entre ellos dos están conectados la batería, para aplicar los potenciales a la celda, y el amperímetro (A), para medir las corrientes eléctricas.
No obstante, se necesita de un electrodo de referencia (3) para poder tener un seguimiento del potencial del electrodo de trabajo, y así conocer la variación del potencial para el electrodo auxiliar. De esta manera, se puede determinar el potencial de toda la celda, Ecelda, necesario para estimar el final de las reacciones redox en uno de los tipos de coulombimetría.
Nótese que entre el electrodo de trabajo y el de referencia casi no fluye corriente debido al voltímetro de alta impedancia (V), gracias al cual se tiene una lectura del potencial para el electrodo de trabajo. Entre estos dos electrodos tenemos un sistema similar al de un análisis potenciométrico: es estático y no dinámico.
Potenciales
La coulombimetría es, por decirlo así, una electrólisis realizada con fines analíticos y cuantitativos. Por lo tanto, se habla de aplicar potenciales externos, suministrados por una batería, para llevar a cabo reacciones electroquímicas no espontáneas; es decir, aquellas que tienen potenciales negativos.
Considérese por ejemplo las siguientes reacciones acompañadas por sus respectivos potenciales estándares:
Cu2+ + 2e– ⇌ Cu(s) Eºred = +0.337 V
H2O ⇌ 1/2O2(g) + 2H+ + 2e– Eºred = +1.230 V
Siendo la ecuación de la reacción global igual a:
Cu2+ + H2O ⇌ Cu(s) + 1/2O2(g) + 2H+ Eºred = -0.893 V
La batería debe aplicar un potencial de 0.893 V para que sea posible la electrodeposición del cobre y la formación de iones de hidrógeno. Este potencial es el Ecelda. Sin embargo, en la práctica, debe aplicarse un potencial mayor al calculado, debido a que hay potenciales que se oponen a la evolución de la reacción:
Ecelda = Ecátodo – Eanodo – OP – IR – CP
Donde,
OP: sobrepotencial (barrera cinética)
IR: potencial óhmico (intrínseco a las celdas)
CP: polarización de las concentraciones (producto de las disminuciones de Cu2+)
Tipos de coulombimetría
Existen en esencia tres tipos de coulombimetría: la amperostática, la potenciostática, y la electrogravimétrica.
Amperostática o galvanostática
En este tipo de coulombimetría se mantiene constante la corriente que recorre la celda mediante el uso de un amperostato. Por lo tanto, teniendo la corriente i gracias a la lectura del amperímetro, y conociendo además el tiempo t una vez finalice la electrólisis, podemos calcular la carga Q asociada a la transformación del analito:
Q = it
Una consecuencia de mantener constante la corriente, es que los potenciales de los electrodos cambian, ya sea positiva o negativamente. Esta variación brusca es indicativo de que el analito ha reaccionado por completo, que es cuando se detiene la electrólisis y se mide t. Esta es la base para las titulaciones coulométricas.
Si se continúa bajando o subiendo el potencial, otras especies electroactivas indeseables terminarán reaccionando. Es por eso que debe conocerse a la perfección los potenciales asociados a las transformaciones de interés.
Potenciostática
Una forma de evitar que otras especies se oxiden o reduzcan, es controlando el potencial de la celda el tiempo que dure la electrólisis. Es aquí donde entra la coulombimetría potenciostática, pues utiliza un potenciostáto para fijar un determinado potencial para la celda. A diferencia de la coulombimetría amperostática, ahora es la corriente la que cambia conforme transcurre el tiempo.
Debido a esta configuración técnica, no podemos calcular Q directamente con los valores de i y t; la corriente disminuye con el tiempo. Esto es así porque a medida que reacciona el analito, cada vez habrá menos moléculas u átomos que donen o acepten electrones. Por lo tanto, Q es igual a una integral del área bajo la curva de la gráficai vs t.
Electrogravimétrica
La coulombimetría electrogravimétrica, conocida sencillamente como electrogravimetría, es una electrólisis en la cual no es necesario medir las cargas ni las corrientes eléctricas. En lugar de eso, se procede a medir las masas de los electrodos antes y después de la electrólisis.
Esta técnica solamente se aplica cuando la especie que se reducen son cationes metálicos que se electrodepositan sobre los electrodos, volviéndolos más pesados.
Aplicaciones
Potenciostáticas
Los análisis potenciostáticos permiten ir reduciendo u oxidando selectivamente una especie a la vez en medio de una mezcla. Por ejemplo, se utilizan para determinar la concentración de los siguientes iones inorgánicos en cantidades trazas, o en matrices complejas:
-Cu2+
-As3+
-Cd2+
-Co2+
-Fe2+ y Fe3+
-Pb2+
-X (F–, Cl–, Br– y I–)
-Ni2+
-Pu3+
-Ag+
-Sn2+
-Zn2+
-U6+
Asimismo, estos análisis pueden utilizarse para determinar la composición de una aleación. Una vez disuelta la aleación en ácido, se van aplicando potenciales de celda de manera escalonada y controlada, determinando así la cantidad reducida para cada catión metálico que la integra.
Titulaciones coulométricas
En las titulaciones coulométricas se utilizan agentes mediadores que se aseguran de neutralizar o reaccionar completamente con el analito remanente. El propósito de esto es evitar que las variaciones del potencial, a una corriente constante, deriven en reacciones colaterales. Así, es posible titular, por ejemplo, el ácido ascórbico utilizando yodo como mediador.
Algunos cationes metálicos, como el Ag+, Ce3+, Fe3+, Mn2+, Ti3+, Cr2+, también pueden determinarse mediante estas titulaciones.
Por otro lado, las reacciones ácido-base pueden seguirse empleando esta técnica, ya que los potenciales grandes ocasionan que el agua se ionice en H3O+ u OH–, los cuales fungen de agentes titulantes que son generados in situ; es decir, neutralizarán los ácidos o las bases presentes.
El CO2 del océano, las reacciones de precipitación, y la formación de complejos con el EDTA, también son posibles analizarlos aplicando titulaciones coulométricas, donde se añaden indicadores redox para resaltar el punto final de las electrólisis.
Referencias
- Day, R., & Underwood, A. (1986). Química Analítica Cuantitativa (quinta ed.). PEARSON Prentice Hall.
- Skoog D.A., West D.M. (1986). Análisis instrumental. (segunda ed.). Interamericana., México.
- Dr. Doug Stewart. (2020). Definition of Coulometry. Recuperado de: chemicool.com
- Wikipedia. (2020). Coulometry. Recuperado de: en.wikipedia.org
- Harvey David. (05 de junio de 2019). Coulometric Methods. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
