Estructura cristalina: qué es, características, tipos, ejemplos
¿Qué es la estructura cristalina?
La estructura cristalina se refiere a la forma en la que están organizados o empaquetados los átomos, iones o moléculas en los sólidos cristalinos tales como los diamantes, la sal (cloruro de sodio) o el azúcar (sacarosa).
Los sólidos cristalinos están formados redes tridimensionales de unas unidades idénticas denominadas celdas unitarias. Estas se asemejan a pequeños bloques de construcción idénticos (como legos) que se unen entre sí para formar los cristales que podemos ver a simple vista.
La estructura cristalina consiste en una descripción de la forma de esta celda unitaria y de la posición exacta que tiene cada átomo dentro de dicha celda.
Características de la estructura cristalina
Están formadas por celdas unitarias que se repiten
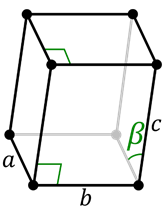
La estructura cristalina consiste en la repetición de una celda unitaria en todas las direcciones. Estas celdas consisten en paralelepípedos tridimensionales cuya forma y tamaño están definidos por tres vectores denominados a, b y c, y por los ángulos entre estos vectores, denominados α, β y γ.
Son estructuras altamente ordenadas
La estructura cristalina se caracteriza por ser uno de los estados de la materia más ordenados que existe. Los cristales son tan ordenados, que con conocer bien la estructura de la celda unidad que contiene tan solo un puñado de átomos, se puede reconstruir toda la estructura entera de un cristal formado por millones de átomos, iones o moléculas.
Presentan simetría
La mayoría de las celdas unitarias con las que se pueden construir sólidos cristalinos presentan algún tipo de simetría. Esto quiere decir que el contenido de una parte de la celda se repite en otra parte de la misma luego de llevar a cabo una rotación, reflexión o inversión.
Por ejemplo, si una celda unitaria posee un plano de simetría, esto quiere decir que una mitad de la celda es el reflejo de la otra.
Relación entre propiedades de la materia y la estructura cristalina
Hay muchas propiedades tanto físicas como químicas que dependen de la estructura cristalina:
Densidad
Dependiendo de la forma como se empaquetan los átomos en la estructura cristalina, se pueden obtener estructuras más compactas o estructuras en la que los átomos están más lejos unos de otros. En el primer caso, se obtendrá un sólido más denso y pesado, ya que se logran empaquetar más átomos en un menor volumen.
Ejemplo
Si comparamos las tres estructuras cristalinas cúbicas que se llaman cúbica simple (P), cúbica centrada en las caras (FCC) y cúbica centrada en el cuerpo (BCC) para átomos iguales, la estructura BCC es 2.6 veces más densa que la FCC, y la FCC es 1.4 veces más densa que la P.
Forma cristalina
La forma de los cristales que podemos ver a simple vista es un reflejo de la estructura cristalina, y en particular, de la celda unitaria. Dependiendo de la estructura de la celda unitaria, los cristales crecerán más en una dirección que en otras, lo que da origen a cristales con formas distintas tales como agujas, cupos, cristales hexagonales, etc.
La anisotropía
Las propiedades físicas como la conductividad térmica o eléctrica y las propiedades magnéticas de la materia muchas veces son mayores a lo largo de una dirección del material que a lo largo de otra.
Esto se llama anisotropía, y estos efectos son particularmente intensos en las estructuras cristalinas debido a que son estructuras muy ordenadas y regulares.
Tipos de estructura cristalina
Las estructuras cristalinas se pueden clasificar según el tipo de celda unitaria por la que están formadas. Estos se caracterizan por los tres lados que se conectan a una de sus aristas (llamados a, b y c) y por los ángulos entre estos lados (llamados α, β y γ).
Esto da origen a 7 sistemas cristalinos. Dentro de cada uno de estos sistemas cristalinos se pueden distinguir a su vez diferentes clases de celdas unitarias. En total, existen 14 celdas unitarias distintas que se denominan las 14 redes de Bravais y se representan a continuación:
Sistema cúbico
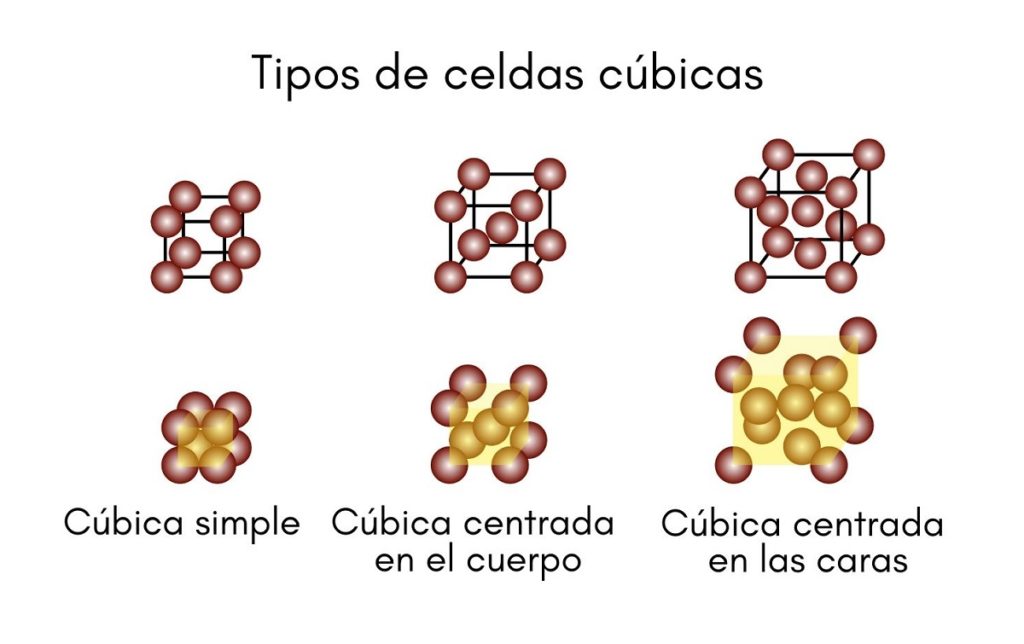
Como su nombre lo indica, la celda unitaria consiste en un cubo perfecto. Los tres lados, a, b y c son iguales entre sí, y sus tres ángulos son todos de 90°. Este sistema está formado por las celdas:
- Cúbica simple o primitiva.
- Cúbica centrada en el cuerpo (BCC).
- Cúbica centrada en las caras (FCC).
Sistema tetragonal
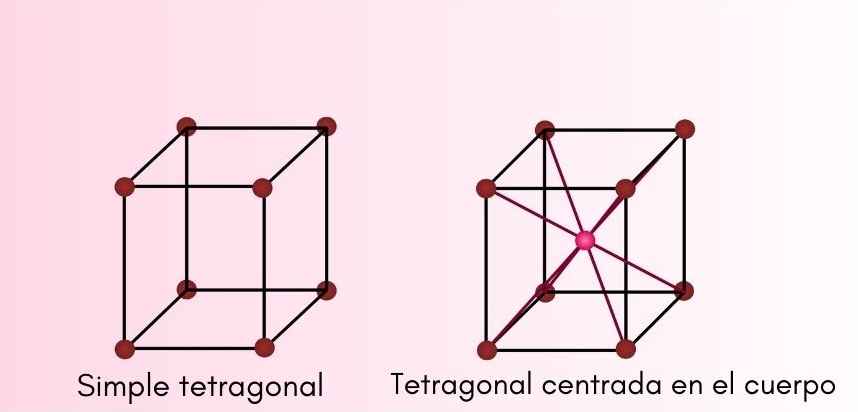
En este tipo de estructura cristalina, a y b son iguales, pero c es diferente, pero todos siguen siendo perpendiculares entre sí. Las celdas tetragonales pueden ser:
- Tetragonal simple o primitiva.
- Tetragonal centrada en el cuerpo.
Sistema ortorrómbico

En este sistema cristalino, a, b y c son todos diferentes, pero siguen siendo perpendiculares entre sí. Hay 4 celdas ortorrómbicas diferentes:
- Ortorrómbica primitiva o simple.
- Ortorrómbica centrada en el cuerpo.
- Ortorrómbica centrada en las bases.
- Ortorrómbica centrada en las caras.
Sistema monoclínico
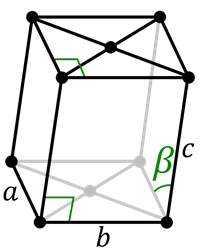
El sistema monoclínico es similar al hexagonal, excepto por el hecho de que todos sus lados son diferentes. Existen dos celdas para el sistema monoclínico:
- Monoclínica primitiva.
- Monoclínica centrada en la base.
Sistema triclínico
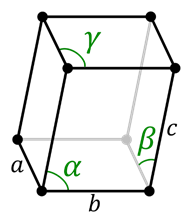
En el sistema triclínico no existe simetría. Todos los ángulos son diferentes entre sí y no necesariamente alguno tiene que ser de 90°. Todos sus lados también son diferentes.
Sistema hexagonal
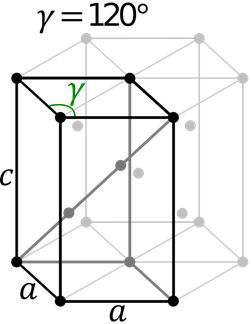
Esta celda contiene lados a y b iguales y lado c diferente. Los ángulos α y β son ambos de 90° mientras que γ=120°.
Sistema trigonal o romboédrica

Este es un tipo particular de estructura similar a tomar un cubo y estirarlo a lo largo de dos vértices opuestos. Todos los lados son iguales y también sus ángulos, pero estos no son de 90°.
Ejemplos de estructuras cristalinas
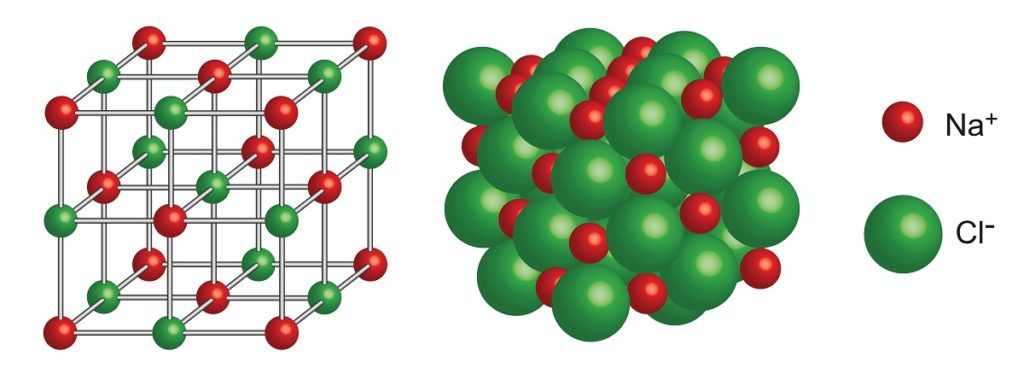
Cloruro de sodio
Su estructura cristalina consiste en una red cúbica centrada en las caras con 4 unidades de NaCl por cada celda unitaria,
Hierro alfa
El hierro cristaliza en forma de hierro alfa a 768 °C. Su estructura es cúbica centrada en el cuerpo con una arista de 2.86 Å (o 286 pm)
Hierro gamma
Es una forma de hierro que se da entre 910 °C y 1400 °C y tiene una estructura cristalina cúbica centrada en las caras de 3.64 Å (364 pm) de arista.
Diamante
El diamante es una de las formas de carbono más valiosas y tiene una estructura cristalina cúbica centrada en las caras (FCC) que contiene dos átomos de carbono y una arista de 3.75 Å (375 pm).
Grafito
El grafito es otra forma muy común de carbono. En este caso se trata de láminas de átomos de carbono unidos entre sí formando anillos de 6 miembros, lo que da origen a una estructura cristalina hexagonal.
