Hidróxido de magnesio: estructura, propiedades, nomenclatura, usos
El hidróxido de magnesio es un compuesto inorgánico cuya fórmula química es Mg(OH)2. En su forma pura es un sólido blanco sin brillo y de apariencia amorfa; sin embargo, con un contenido pequeño y exacto de impurezas se transforma en el sólido cristalino brucita, mineral que se encuentra en ciertos depósitos en la naturaleza, y es una fuente rica de magnesio.
Es un electrolito o base débil, por lo que su disociación es baja en agua. Esta propiedad hace del Mg(OH)2 un buen neutralizador de la acidez para consumo humano; remedio conocido popularmente como la suspensión de leche de magnesia. Asimismo, es un retardante de incendios al liberar agua durante su descomposición térmica.

En la imagen superior se muestran algunos sólidos de hidróxido de magnesio, en los que se aprecian su color blanco opaco. Mientras más cristalinos sean, desarrollan superficies vidriosas y perladas.
Su estructura cristalina es peculiar ya que establece cristales hexagonales de doble capas, las cuales son diseños prometedores para el diseño de nuevos materiales. En estas capas juegan un papel importante sus cargas positivas debido a la sustitución del Mg2+ por cationes trivalentes, y a las especies confinadas entre las paredes compuestas por aniones OH–.
Por otro lado, otras aplicaciones derivan en función de la morfología de las partículas o nanopartículas preparadas; como catalizadores o adsorbentes. En todas ellas, se mantiene constante la relación 1:2 para los iones Mg2+:OH–, reflejada en la misma fórmula Mg(OH)2.
Índice del artículo
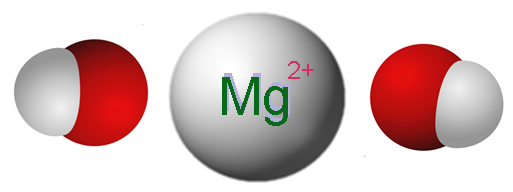
En la imagen superior se muestran los iones que componen el Mg(OH)2. Tal como puede apreciarse, hay dos aniones OH– por cada catión Mg2+, los cuales interaccionan electrostáticamente para definir un cristal de estructura hexagonal. La misma fórmula indica que la relación Mg:OH es 1:2.
No obstante, la verdadera estructura cristalina es un poco más intrincada que asumir simples iones Mg2+ y OH–. En realidad, el magnesio se caracteriza por tener un número de coordinación de 6, por lo que puede interaccionar hasta con seis OH–.
Así, se forma el octaedro Mg(OH)6, donde los átomos de oxígeno evidentemente provienen de los OH–; y la estructura cristalina ahora descansa en la consideración de tales octaedros y cómo interaccionan unos con otros.
De hecho, las unidades Mg(OH)6 terminan definiendo estructuras de doble capas que, a su vez, se ordenan en el espacio para originar el cristal hexagonal.
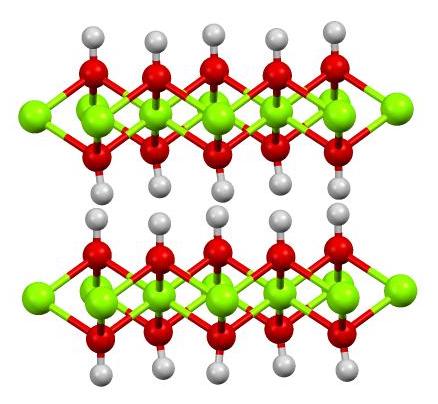
En la imagen superior se muestra la estructura de doble capa de hidróxido de magnesio (LDH, por sus siglas en inglés: Layered double hydroxides). Las esferas de color verde representan a los iones Mg2+, los cuales pudieran ser sustituidos por otros de mayor carga para generar una carga positiva en la capa.
Nótese que entorno a cada Mg2+ hay seis esferas rojas conectadas a sus respectivas esferas blancas; es decir, las unidades octaédricas Mg(OH)6. El OH– actúa como un puente para unir dos Mg2+ de planos diferentes, lo que hace que las capas estén compenetradas.
Asimismo, se observa que los átomos de hidrógeno apuntan hacia arriba y hacia abajo, y son los primeros responsables de que las fuerzas intermoleculares mantengan unidas las dos capas de unidades Mg(OH)6.
Entre estas capas pueden alojarse moléculas neutras (como alcoholes, amoníaco y nitrógeno) o inclusive aniones, en función de qué tan positivas estén (si hay iones Al3+ o Fe3+ sustituyendo al Mg2+). El “relleno” de dichas especies se halla confinado por las superficies compuestas por los aniones OH–.
El cristal hexagonal y de doble capa va creciendo lenta o rápidamente. Todo depende de los parámetros de síntesis o preparación: temperatura, relación molar, agitación, solventes, reactivos como fuente de magnesio, bases o agentes precipitantes, etc. A medida que crece el cristal, define la microestructura o morfología de sus nanopartículas o agregados.
Así, estas nanopartículas pueden tener morfologías de tipo platos, plaquetas, o glóbulos de coliflor. Igualmente, la distribución de sus tamaños puede cambiar, al igual que el grado de porosidad de los sólidos resultantes.
Es un sólido blanco, granulado o en polvo, e inodoro.
58,3197 g/mol.
3,47 g/mL.
350 ºC. A esta temperatura se descompone en el óxido al liberar las moléculas de agua contenida en sus cristales:
Mg(OH)2(s) => MgO(s) + H2O(g)
0,004 g/100 mL a 100 ºC; es decir, apenas logra disolverse en agua hirviendo, por lo que es un compuesto insoluble en agua. Sin embargo, al disminuir el pH (o aumentar la acidez) su solubilidad se incrementa por la formación del acuo complejo, Mg(OH2)6.
Por otro lado, si el Mg(OH)2 ha absorbido CO2, liberará el gas retenido como efervescencia cuando se disuelva en un medio ácido.
1,559
Una suspensión acuosa del mismo tiene un pH que varía entre 9,5 y 10,5. Aunque estos valores sean normales, refleja su poca basicidad frente a otros hidróxidos metálicos (como el NaOH).
77.03 J/mol·K

El hidróxido de magnesio puede encontrarse en la naturaleza como el mineral brucita, el cual se caracteriza por su color blanco transparente, con tonalidades verdes o azuladas dependiendo de sus impurezas. Asimismo, la brucita forma parte de algunas arcillas, como la clorita, al intercalarse entre las capas de los silicatos, unidas por iones metálicos.
En la brucita hay otros iones además del Mg2+, como el Al3+, Fe3+, Zn2+ y Mn2+. Sus menas pueden encontrarse en distintas regiones o lagos de Escocia, Canadá, Italia y USA.
Físicamente sus cristales parecen vidrios fundidos (imagen superior), con colores blancos, grisáceos, azulados o verdosos, y transparentes en raros ejemplares.
Este mineral es uno de los males que afectan los cementos y el hormigón, ya que tiende a expandirse y causar fracturas en ellos. No obstante, no absorbe CO2, por lo que su calcinación no contribuye al efecto invernadero y, por ende, es una fuente mineralógica apropiada (y la más rica) para obtener magnesio, además del agua de mar.
El Mg(OH)2 tiene hasta tres nombres aceptados por la IUPAC (fuera de la mineralogía o medicina). Estos son muy parecidos entre sí, ya que apenas varía el modo en como terminan.
Por ejemplo, el ‘hidróxido de magnesio’ corresponde a su nombre de acuerdo a la nomenclatura stock, omitiendo el (II) al final porque el +2 es casi por defecto el único estado de oxidación del magnesio.
‘Dihidróxido de magnesio’, señalando con el prefijo numerador griego el número de iones OH– indicados en la fórmula según la nomenclatura sistemática. Y ‘hidróxido magnésico’, terminando con el sufijo –ico por ser el máximo y “único” estado de oxidación del magnesio, de acuerdo a la nomenclatura tradicional.
Los demás nombres, como brucita o leche magnesia, si bien están directamente relacionados con este compuesto, no conviene referirse a él cuando se trata de su sólido más puro, o como compuesto inorgánico (reactivo, materia prima, etc.).
El Mg(OH)2 debe a su baja solubilidad en agua el hecho de que sea un excelente neutralizador de la acidez; de lo contrario, basificaría el medio al aportar grandes concentraciones de iones OH–, tal y como lo hacen otras bases (electrolitos fuertes).
Así pues, el Mg(OH)2 apenas libera OH–, al mismo tiempo que reacciona con los iones H3O+ para formar el acuo complejo de magnesio, mencionado también anteriormente. Al poder neutralizar la acidez de medios acuosos, se destina para el tratamiento de las aguas residuales.
Asimismo, es un aditivo de alimentos, fertilizantes, y de ciertos productos de higiene personal, como la pasta dental, ya que disminuye su acidez.
Al ser poco soluble en agua, puede ingerírsele sin correr el riesgo de los efectos de sus iones OH– (se disocia muy poco como electrolito débil).
Esta característica, vinculada con el subapartado de arriba, lo vuelve un antiácido para tratar la acidez estomacal, enfermedades gastrointestinales, indigestión y el estreñimiento, vendido bajo la fórmula de la leche de magnesia.
Por otro lado, la leche de magnesia también ayuda a combatir las molestas aftas (las llagas blancas y enrojecidas que aparecen en la boca).
En el apartado de las propiedades se hizo mención de que el Mg(OH)2 se descompone liberando agua. Precisamente, dicha agua ayuda a detener el avance de las llamas, ya que absorben calor para vaporizarse y, a su vez, los vapores diluyen los gases combustibles o inflamables.
El mineral brucita suele utilizarse industrialmente para esta finalidad, destinada como relleno en determinados materiales, como plásticos de diferentes polímeros (PVC, resinas, cauchos), cables o techos.
El Mg(OH)2 sintetizado como nanoplaquetas ha demostrado ser eficiente para catalizar las reducciones químicas; por ejemplo, la del 4-nitrofenol (Ph-NO2) a 4-aminofenol (Ph-NH2). Asimismo, estas presentan actividad antibacterial, por lo que podría utilizarse como agente terapéutico.
Algunos sólidos de Mg(OH)2 pueden ser bastante porosos, dependiendo del método de su preparación. Por lo tanto, encuentran aplicación como adsorbentes.
En disoluciones acuosas pueden adsorber (sobre sus superficies) las moléculas de colorantes, clarificando el agua. Por ejemplo, son capaces de adsorber el colorante carmín de índigo presente en corrientes de agua.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Wikipedia. (2019). Magnesium hydroxide. Recuperado de: en.wikipedia.org
- National Center for Biotechnology Information. (2019). Magnesium hydroxide. PubChem Database. CID=14791. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Amethyst Galleries. (2014). The mineral brucite. Recuperado de: galleries.com
- Henrist y col. (2003). Morphological study of magnesium hydroxide nanoparticles
- precipitated in dilute aqueous solution. Journal of Crystal Growth 249, 321–330.
- Saba J., Shanza R. K., Muhammad R. S. (2018). Synthesis and structural analysis of mesoporous magnesium hydroxide nanoparticles as efficient catalyst.
- Thimmasandra Narayan Ramesh and Vani Pavagada Sreenivasa. (2015). Removal of Indigo Carmine Dye from Aqueous Solution Using Magnesium Hydroxide as an Adsorbent. Journal of Materials, vol. 2015, Article ID 753057, 10 pages. doi.org/10.1155/2015/753057
