Tensión superficial: causas, ejemplos, aplicaciones y experimentos
La tensión superficial es una propiedad física que presentan todos los líquidos y se caracteriza por la resistencia que sus superficies oponen a cualquier aumento de su área. Esto es lo mismo que decir que dicha superficie buscará la menor área posible. Este fenómeno entrelaza varios conceptos químicos, como lo son las fuerzas de cohesión, adhesión e intermoleculares.
La tensión superficial es responsable de la formación de las curvaturas de la superficie de los líquidos en recipientes tubulares (cilindros graduados, columnas, tubos de ensayo, etc.). Estos pueden ser cóncavos (curvados en forma de valle) o convexos (curvados en forma de domo). Muchos fenómenos físicos pueden explicarse considerando los cambios que sufre la tensión superficial de un líquido.

Uno de estos fenómenos es la tendencia que tienen las moléculas de los líquidos en aglomerarse en forma de gotas, cuando descansan sobre superficies que los repelen. Por ejemplo, las gotas de agua que vemos encima de las hojas, no pueden mojarla debido a su superficie cerosa, hidrofóbica.
No obstante, llega un momento en que la gravedad ejerce su rol y la gota se derrama como una columna de agua. Fenómeno similar se presenta en las gotas esféricas de mercurio cuando se derrama de un termómetro.
Por otro lado, la tensión superficial del agua es la más importante de todas, pues contribuye y organiza el estado de los cuerpos microscópicos en medios acuosos, tales como las células y sus membranas lipídicas. Además, esta tensión se responsabiliza de que el agua se evapore con lentitud, y algunos cuerpos más densos que ella puedan flotar sobre su superficie.
Índice del artículo
- 1 Causas de la tensión superficial
- 2 Unidades
- 3 Tensión superficial del agua
- 4 Otros ejemplos
- 5 Aplicaciones
- 6 Experimentos sencillos
- 7 Referencias
La explicación del fenómeno de la tensión superficial se encuentre en el nivel molecular. Las moléculas de un líquido interaccionan unas con otras, de tal modo que están cohesionadas en sus erráticos movimientos. Una molécula interactúa con sus vecinos de al lado y con los que están arriba o debajo de ella.
Sin embargo, esto no sucede igual con las moléculas de la superficie del líquido, las cuales están en contacto con el aire (o cualquier otro gas), o con un sólido. Las moléculas de la superficie no pueden cohesionar con las del medio externo.
Como resultado, no experimentan ninguna fuerza que las atraiga hacia arriba; solo hacia abajo, de sus vecinas del medio líquido. Para contrarrestar este desequilibrio, las moléculas de la superficie se “apretujan”, pues solo así logran vencer la fuerza que las empujan hacia abajo.
Se crea entonces una superficie donde las moléculas están en una disposición más tensa. Si una partícula quiere penetrar el líquido, primero debe atravesar esta barrera molecular proporcional a la tensión superficial de dicho líquido. Lo mismo aplica para una partícula que quiera escapar al medio externo desde las profundidades del líquido.
Por lo tanto, su superficie se comporta como si fuera una película elástica que muestra resistencia a deformarse.
La tensión superficial usualmente se representa con el símbolo γ, y viene expresada en unidades N/m, fuerza por longitud. Sin embargo, la mayoría de las veces su unidad es el dyn/cm. Una se puede convertir en la otra mediante el siguiente factor de conversión:
1 dyn/cm = 0,001 N/m
El agua es el más raro y sorprendente de todos los líquidos. Su tensión superficial, así como varias de sus propiedades, presentan un valor inusualmente alto: 72 dyn/cm a temperatura ambiente. Este valor puede aumentar a 75,64 dyn/cm, a una temperatura de 0 ºC; o disminuir a 58,85 ºC, a una temperatura de 100 ºC.
Estas observaciones tienen sentido si se considera que la barrera molecular se tensa todavía más a temperaturas cercanas al punto de congelamiento, o se “afloja” un poco más rondando el punto de ebullición.
El agua presenta una gran tensión superficial a raíz de sus puentes de hidrógeno. Si estos de por sí son notorios en el seno del líquido, lo son aún más en la superficie. Las moléculas de agua se entrelazan fuertemente formando interacciones dipolo-dipolo del tipo H2O—H-O-H.
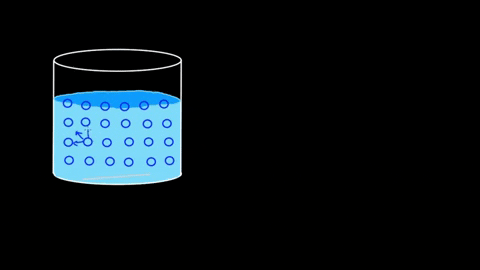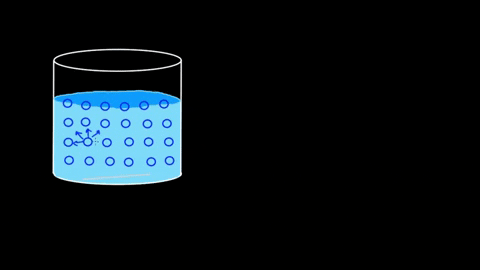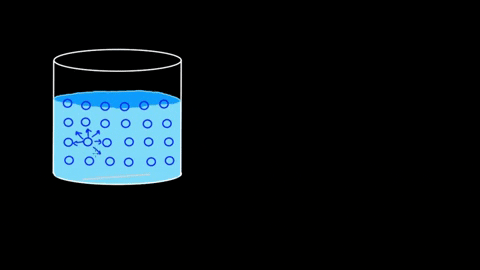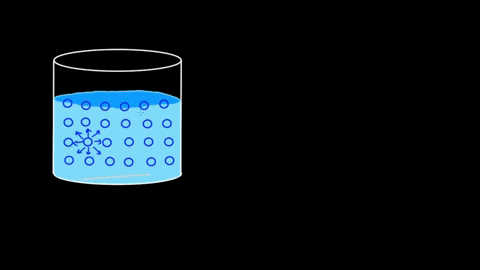
Es tal la eficiencia de sus interacciones, que la barrera molecular acuosa puede incluso sostener algunos cuerpos antes de que se hundan. En los apartados de aplicaciones y experimentos se retomará este punto.
Todos los líquidos presentan tensiones superficiales, ya sea en menor o mayor grado al del agua, o si se tratan de sustancias puras o soluciones. Qué tan fuertes y tensas sean las barreras moleculares de sus superficiales, dependerá directamente de sus interacciones intermoleculares, además de factores estructurales y energéticos.
Por ejemplo, las moléculas de los gases en estado líquido solo interaccionan entre sí mediante fuerzas dispersivas de London. Esto concuerda con el hecho de que sus tensiones superficiales tengan valores bajos:
-Helio líquido, 0,37 dyn/cm a -273 ºC
-Nitrógeno líquido, 8,85 dyn/cm a -196 ºC
-Oxígeno líquido, 13,2 dyn/cm a -182 ºC
La tensión superficial del oxígeno líquido es mayor que la del helio porque sus moléculas tienen mayor masa.
De los líquidos apolares y orgánicos se espera que tengan tensiones superficiales más elevadas que la de estos gases condensados. Entre algunos de ellos tenemos los siguientes:
-Dietileter, 17 dyn/cm a 20 ºC
–n-Hexano, 18,40 dyn/cm a 20 ºC
–n-Octano, 21,80 dyn/cm a 20 ºC
-Tolueno, 27,73 dyn/cm a 25 ºC
Una tendencia similar se observa para estos líquidos: la tensión superficial se incrementa a medida que aumenta sus masas moleculares. Sin embargo, el n-octano debería, según esto, tener la mayor tensión superficial y no el tolueno. Aquí entra en juego las estructuras y geometrías moleculares.
Las moléculas de tolueno, planas y anillares, tienen interacciones más efectivas que las del n-octano. Por lo tanto, la superficie del tolueno es “más tensa” que la superficie del n-octano.
Al haber interacciones dipolo-dipolo más fuertes entre las moléculas de un líquido polar, su tendencia es el de mostrar mayores tensiones superficiales. Pero no siempre es el caso. Entre algunos ejemplos tenemos:
-Ácido acético, 27,60 dyn/cm a 20 ºC
-Acetona, 23,70 dyn/cm a 20 ºC
-Sangre, 55,89 dyn/cm a 22 ºC
-Etanol, 22,27 dyn/cm a 20 ºC
-Glicerol, 63 dyn/cm a 20 ºC
-Cloruro de sodio fundido, 163 dyn/cm a 650 ºC
-Solución de NaCl 6 M, 82,55 dyn/cm a 20 ºC
El cloruro de sodio fundido es de esperarse que tenga una tensión superficial enorme: es un líquido viscoso e iónico.
Por otro lado, el mercurio es uno de los líquidos de mayor tensión superficial: 487 dyn/cm. En él, su superficie está compuesta por átomos de mercurio fuertemente cohesionados, mucho más de lo que pueden estarlo las moléculas de agua.

La tensión superficial por sí sola carece de aplicaciones. Sin embargo, esto no quiere decir que no esté implicada en varios fenómenos diarios, que de no existir, no ocurrirían.
Por ejemplo, los zancudos y otros insectos son capaces de caminar por el agua. Esto se debe a que sus patas hidrofóbicas repelen el agua, al mismo tiempo que su poca masa les permite mantenerse a flote sobre la barrera molecular sin que caigan al fondo del río, lago, estanque, etc.

La tensión superficial también cumple un rol en la mojabilidad de los líquidos. Mientras mayor sea su tensión superficial, menor será su tendencia a filtrarse por los poros o resquicios de un material. Además de esto, resultan líquidos poco útiles para limpiar superficies.
Es aquí donde los detergentes actúan, disminuyendo la tensión superficial del agua, y ayudándola a cubrir mayores superficies; a la vez que mejora su acción desengrasante. Al disminuir su tensión superficial da cabida a moléculas de aire, con las cuales forma burbujas.
Por otro lado, tensiones superiores bajas se vinculan con la estabilización de las emulsiones, importantísimas en la formulación de distinta gama de productos.

Para finalizar se citarán algunos experimentos que pueden realizarse en cualquier espacio doméstico.
En un vaso con agua fría se coloca sobre su superficie un clip metálico. Tal como se observa en la imagen superior, el clip permanecerá a flote gracias a la tensión superficial del agua. Pero si se le añade al vaso un poco de lava loza, la tensión superficial disminuirá drásticamente y el clip se hundirá de pronto.

Si en la superficie tenemos un barco de papel o una paleta de madera, y si la lava loza o el detergente se añade en la cabeza de un hisopo, entonces ocurrirá un fenómeno interesante: habrá una repulsión que los propagarán hacia los bordes del vaso. El barco de papel y la paleta de madera se moverán alejándose del hisopo untado con detergente.

Otro experimento similar y más gráfico consiste en repetir la misma operación, pero en un balde de agua rociado con pimienta negra. Las partículas de pimienta negra se alejarán y la superficie pasará de estar cubierta de pimienta a ser cristalina, con la pimienta en los bordes.
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Wikipedia. (2020). Surface tension. Recuperado de: en.wikipedia.org
- USGS. (s.f.). Surface Tension and Water. Recuperado de: usgs.gov
- Jones, Andrew Zimmerman. (12 de febrero de 2020). Surface Tension – Definition and Experiments. Recuperado de: thoughtco.com
- Susanna Laurén. (15 de noviembre de 2017). Why is surface tension important? Biolin Scientific. Recuperado de: blog.biolinscientific.com
- Rookie Parenting Science. (07 de noviembre de 2019). What Is Surface Tension | Cool Science Experiment. Recuperado de: rookieparenting.com
- Jessica Munk. (2020). Surface Tension Experiments. Study. Recuperado de: study.com
- The Kid Should See This. (2020). Seven surface tension experiments – Physics Girl. Recuperado de: thekidshouldseethis.com
