Butanona: estructura, propiedades y usos
La butanona es un compuesto orgánico, específicamente una cetona, cuya fórmula química es CH3CH2COCH3. Su apariencia es la de un líquido incoloro usado fundamentalmente como solvente. Tiene propiedades semejantes a la acetona, pero ebulle a una temperatura más alta y se evapora más lentamente.
Se produce por la deshidrogenación catalítica del 2-butanol (compuesto quiral). Sin embargo, se encuentra en estado natural en la composición de algunas frutas. Forma parte de las emanaciones de los tubos de escape de los vehículos, y es un componente del humo de los tabacos.
Es después de la acetona la más simple de esta familia de compuestos orgánicos. La butanona causa irritación en los ojos y la nariz. A dosis inusualmente altas puede provocar irritación de la mucosa pulmonar. Por otro lado, este líquido es considerado un agente precursor de narcóticos.
La butanona presenta gran solubilidad en el agua; pero también es muy soluble en solventes orgánicos como etanol, éter, acetona, benceno y cloroformo. Esto podría explicarse porque su valor del log de P (0,29) para el coeficiente de partición octano/agua es bajo.
Índice del artículo
- 1 Estructura de la butanona
- 2 Propiedades
- 2.1 Fórmula molecular
- 2.2 Nombres
- 2.3 Masa molar
- 2.4 Descripción física
- 2.5 Olor
- 2.6 Punto de ebullición
- 2.7 Punto de fusión
- 2.8 Punto de ignición
- 2.9 Solubilidad en agua
- 2.10 Solubilidad en solventes orgánicos
- 2.11 Densidad
- 2.12 Densidad de vapor
- 2.13 Presión de vapor
- 2.14 Coeficiente de partición octanol/agua
- 2.15 Temperatura de auto ignición
- 2.16 Descomposición
- 2.17 Viscosidad
- 2.18 Calor de combustión
- 2.19 Calor de vaporización
- 2.20 Tensión superficial
- 2.21 Potencial de ionización
- 2.22 Umbral de olor
- 2.23 Índice de refracción
- 2.24 Constante de disociación
- 2.25 Estabilidad
- 3 Usos
- 4 Referencias
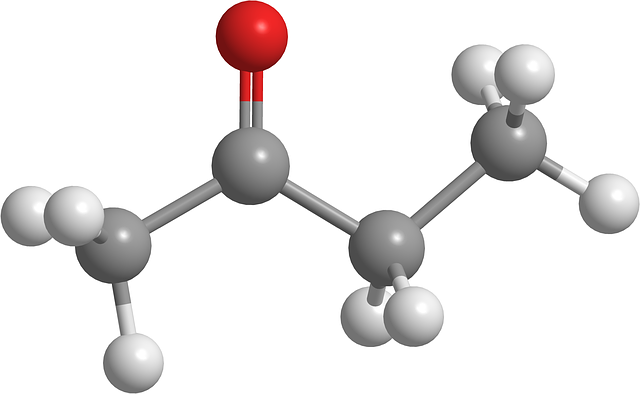
En la imagen superior se muestra la molécula de butanona con un modelo de esferas y barras. Puede apreciarse en el segundo carbono el átomo de oxígeno del grupo carbonilo (esfera roja). Este grupo, C=O, es el responsable de conferirle a la molécula un momento dipolar permanente.
La butanona, vista estructuralmente, no es más que una acetona a la cual se le ha añadido un grupo metileno, CH2. Al haber más carbonos, el momento dipolar es más pequeño en comparación al de la acetona; pero su mayor masa molecular hace que hierva a una temperatura superior.
Esta molécula, al igual que otras cetonas, carece de la posibilidad de formar puentes de hidrógeno; y por lo tanto, sus interacciones dipolo-dipolo no son tan fuertes.
Por eso es un líquido volátil. Al descender la temperatura (-86,6°C), sus dipolos débiles son los que orientan sus moléculas ordenadamente para formar un cristal. Además de esto, se puede comentar además que la butanona es estructuralmente asimétrica.
C4H8O o CH3COCH2CH3
– Butanona.
– 2-butanona.
– Butan-2-ona.
– Metil etil cetona.
72,107 g/mol.
Líquido incoloro.
Fragante a menta, moderadamente fuerte.
79,59 ºC a 760 mmHg.
-86.6 ºC.
-9 ºC (copa cerrada).
29 g /100 mL a 20 ºC. Si bien su momento dipolar es menor que el de la acetona, puede todavía interactuar en un grado excelente con las moléculas de agua. De ellas recibe puentes de hidrógeno: (CH3)(CH2CH3)C=O— HOH. Debido a esto es muy soluble en agua.
Soluble en benceno, alcohol y éter; miscible con aceites, etanol, éter, acetona, benceno y cloroformo. Nótese que la butanona es soluble en una amplia variedad de solventes.
0,7997 g/cm3 a 25 ºC.
2,41 (con relación al agua = 1).
90,6 mmHg a 25 ºC.
Log P = 0,29
505 ºC.
Se descompone por procesos fotoquímicos mediante la oxidación por radicales hidroxilos libres, así como por descomposición por fotólisis directa. Cuando se calienta a descomposición emite un humo acre.
0,40 cPoise a 25 ºC.
2.444,1 kJ/mol a 25 ºC.
31,30 kJ/mol en el punto de ebullición; y 34,79 kJ/mol a 25 ºC.
23,97 mN/m a 25 ºC.
0,54 eV.
Olor bajo: 0,735 mg/m3.
Olor alto: 147,5 mg/m3.
1,788 a 20 ºC.
pKa = 14,70.
Estable, pero altamente inflamable. Incompatible con agentes oxidantes, bases, y agentes reductores fuertes. Debe evitarse la humedad.
La butanona es utilizada como solvente en la elaboración de revestimientos de superficies, fabricación de polvo sin humo, elaboración de resinas de colores, y en la eliminación de acumulación de grasa producida por lubricantes.
Además, es utilizada en la elaboración de:
– Cuero artificial.
– Gomas.
– Lacas.
– Barnices.
– Pegamentos.
– Disolventes.
– Removedores de pintura.
– Adhesivos.
– Cementos plásticos.
– Selladores.
– Cintas magnéticas.
– Papel transparente.
– Tintas de impresión.
– Cosméticos y productos farmacéuticos.
También se utiliza como solvente para el desgrasado de superficies metálicas, limpiadores de equipos electrónicos, y extracción de grasas. Sirve para la extracción de madera dura y aceite vegetal.
Es un ingrediente inerte en la elaboración de pesticidas, y en la manufactura del acetato y nitrato de celulosa.
Se utiliza como solvente de extracción en el procesamiento de alimentos y de ingredientes de alimentos; por ejemplo, en el fraccionamiento de grasas y aceites, así como en el proceso de descafeinado del café. También se usa como solvente en los marcadores empleados en las pizarras blancas.
– La butanona es empleada como fotoiniciador soluble en agua para la fotopolimerizción del ácido metacrílico.
– Se condensa con el formaldehido para producir isopropenil cetona.
– Experimenta autocodensación para la producción del etil amilo cetona.
– Reacciona con citral para la obtención de componentes de perfume como la metilpseudoionona.
– Interviene como catalizador en la producción de hidracina.
– Adicionalmente, es precursor del peróxido de metil etil cetona, el cual es un catalizador para algunas reacciones de polimerización.
La butanona tiene aplicación como agente de soldadura de plásticos, con uso en el armado de modelos a escala de poliestireno. La butanona va disolviendo el poliestireno, permitiendo que los bordes se unan al producirse una nueva polimerización. Este comportamiento es de un cemento y no de un pegamento.
La butanona se utiliza como esterilizador de esporas de bacterias en instrumentos de cirugía, agujas, inyectadoras hipodérmicas e instrumentos odontológicos.
Se emplea como agente saborizante de alimentos en concentraciones muy bajas; por ejemplo, en las bebidas alcohólicas la concentración es de 20 ppm; en los productos horneados, de 12,7 ppm; las carnes tienen alrededor de 26,5 ppm; la goma de mascar, de 0,63 ppm; y en grasas y aceites, de 1,0 ppm.
Y finalmente, la butanona es utilizada en la separación de la apoproteína del grupo hemo en las hemoproteínas.
- Morrison, R. T. y Boyd, R, N. (1987). Química Orgánica. 5ta Edición. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. Amines. (10thedition.). Wiley Plus.
- National Center for Biotechnology Information. (2019). Methyl ethyl ketone PubChem Database. CID=6569. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Butanone. Recuperado de: en.wikipedia.org
- Royal Society of Chemistry. (2015). Butanone. Chemspider. Recuperado de: chemspider.com
- Arlem Cheprasov. (2019). What is butanone? Formula & uses. Study. Recuperado de: study.com
- Vasler Ben. (17 de mayo de 2017). Butanone. Chemistry World. Recuperado de: chemistryworld.com
