Procesos termodinámicos: qué son, tipos, ejemplos
¿Qué son los procesos termodinámicos?
Los procesos termodinámicos son procesos en los que un sistema termodinámico bajo estudio sufre un cambio de estado. Durante este cambio de estado, ocurre un movimiento de energía bien sea dentro del sistema o entre el sistema y los alrededores. De hecho, esta es la razón por la que se denominan procesos termodinámicos, ya que termo– se refiere a calor (una forma de energía) y –dinámico se refiere a movimiento.
Por cambio de estado no se hace referencia necesariamente a pasar de sólido a líquido o de líquido a gas (aunque esos también son procesos termodinámicos), sino a un cambio en las funciones de estado, es decir, en las variables que definen el estado del sistema tal como la temperatura, el volumen y la presión.
Los procesos termodinámicos ocurren por todas partes. De hecho, prácticamente cualquier proceso de cambio para el cual se pueda definir un sistema se puede considerar un proceso termodinámico. Desde un helado derritiéndose hasta el funcionamiento de un motor de combustión interna o el funcionamiento de una licuadora.
Tipos de procesos termodinámicos
Existen una gran variedad de procesos termodinámicos, por lo que es necesario clasificarlos para poder facilitar su estudio. Los criterios principales para clasificar los procesos termodinámicos son:
- Según el tipo de cambio en el sistema
- Según la función de estado que permanece constante
- De acuerdo a la segunda ley de la termodinámica
1. Tipos de procesos termodinámicos según el tipo de cambio
Cambios en el sistema
Este tipo de proceso termodinámico se caracteriza por el paso del sistema desde un estado inicial hasta uno final, definidos ambos por un número adecuado de variables de estado. En este tipo de procesos, el sistema se encuentra en equilibrio termodinámico tanto en el estado inicial como en el estado final y el cambio es ocasionado por algún agente externo.
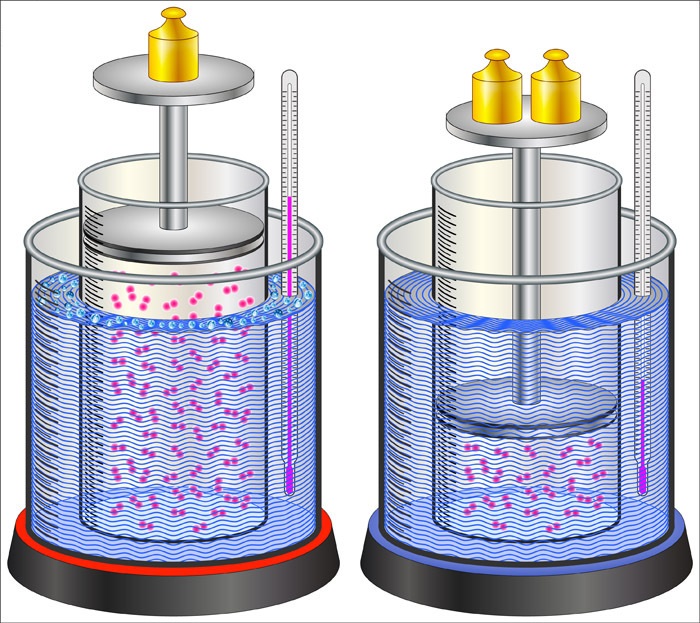
La condición de equilibrio termodinámico es una condición macroscópica, que implica que el sistema no sufrirá ningún cambio en el tiempo a menos que sea perturbado por alguna fuerza externa. Esta puede consistir en el aporte de energía en forma de calor, trabajo, entre otros.
Cabe destacar que, al estudiar procesos de cambio en el sistema, muchas veces (aunque no siempre) el proceso en sí no es de importancia sino solo el estado inicial y el estado final.
Procesos cíclicos
En muchas situaciones, en especial en la construcción de máquinas basadas en procesos termodinámicos, se somete al sistema a un conjunto de procesos de cambio de estado que parten de un estado inicial, pasan por un conjunto de estados intermedios y terminan nuevamente en el mismo estado inicial original, completando así un ciclo.

Los procesos cíclicos no producen un cambio neto en el estado del sistema (ya que comienzan y terminan en el mismo estado), pero dependiendo de cómo se lleve a cabo el ciclo, pueden producir la transferencia neta de energía de una parte de los alrededores a otra o entre otros dos sistemas separados.
Un ejemplo de procesos cíclicos es lo que ocurre dentro de los pistones de un motor de combustión interna, así como el conjunto de procesos que ocurren dentro del compresor de los sistemas de refrigeración.
Procesos de flujo
Los procesos de flujo se diferencian de los otros dos tipos de procesos, en que el sistema está conformado por la materia que se encuentra en un momento dado dentro de un recipiente por el cual pasa un flujo constante de materia.

Este tipo de procesos termodinámicos son de uso común en ingeniería, y las propiedades de interés son, en general, las tasas de entrada y salida de energía hacia y desde el recipiente a medida que lo atraviesa la materia que puede ser un líquido puro, una solución, una mezcla reactante, etc.
2. Tipos de procesos termodinámicos según la función de estado que permanece constante
Para facilitar su análisis e interpretación, muchos procesos termodinámicos se llevan a cabo manteniendo una o más variables constantes. De esta manera, se puede determinar los efectos sobre el sistema del cambio de un número reducido de variables. Esto hace que se puedan definir distintos tipos de sistemas termodinámicos según cuál variable permanece constante. Estos son:
Procesos isotérmico (T=ctte)
Son aquellos procesos en los cuales la temperatura permanece constante. A pesar de no parecer intuitivo, el hecho de que no cambie la temperatura no significa que no haya transferencia de calor. Durante estos procesos no hay cambio en la energía interna del sistema.
Procesos isocóricos (V=ctte)
Son los procesos que ocurren sin cambio de volumen. En general ocurren en sistemas cerrados con paredes rígidas (que no se pueden deformar). También se llaman isovolumétricos e isométricos. Se caracterizan por no involucrar trabajo de expansión P-V.
Procesos isobáricos (P=ctte)
Es tal vez el tipo más común de proceso termodinámico con el que nos topamos en nuestra vida diaria. Se caracterizan por ocurrir a presión constante.
Procesos adiabáticos (q=0)
Estos son los procesos que ocurren sin transferencia alguna de calor. Suelen confundirse con los procesos isotérmicos ya que, al no haber transferencia de calor, muchos asumen que no hay cambio de temperatura. Sin embargo, esto no es así.
Procesos isoentrópicos (S=ctte)
Son procesos en los que la entropía del sistema permanece constante.
Procesos isoentálpicos (H=ctte)
Son aquellos procesos en los que la entalpía del sistema permanece constante.
3. Tipos de procesos termodinámicos de acuerdo a la segunda ley de la termodinámica
La segunda ley se utiliza para predecir la espontaneidad de los procesos termodinámicos. En base a eso, se pueden distinguir los siguientes tipos de procesos:
Procesos espontáneos
Son aquellos que implican un aumento en la entropía del universo y, por lo tanto, ocurren espontáneamente (de manera natural).
Procesos reversibles
Este tipo de procesos no involucra cambio en la entropía del universo y, por lo tanto, se encuentra en equilibrio. Son procesos reversibles que pueden ocurrir en ambas direcciones.
Procesos irreversibles
Son aquellos que implican una disminución de la entropía del universo y, por lo tanto, no ocurren de manera natural desde el estado inicial hasta el final, pero sí en sentido contrario.
Ejemplos de procesos termodinámicos
- El ciclo de Carnot es un proceso cíclico de 4 etapas, en el cual se basan los sistemas de refrigeración como los compresores de las neveras.
- La evaporación de un charco de agua es un ejemplo de un proceso termodinámico irreversible.
- La formación de escarcha en un congelador es un proceso irreversible.
- El enfriamiento de un gas que se encuentra presurizado al dejarlo escapar de la bombona es un ejemplo de un proceso aproximadamente adiabático.
- La combustión del gas de cocina ocurre en el aire a presión atmosférica constante, así que se considera un proceso isobárico.
- El calentamiento de agua en un calentador a gas es un proceso de flujo, ya que el agua entra y sale de la tubería a una tasa constante, a la vez que absorbe el calor proveniente de la combustión del gas.
