Saponificación: qué es, reacción, importancia, ejemplo

¿Qué es la saponificación?
La saponificación es el proceso químico por medio del cual se hace el jabón. De hecho, saponificación significa literalmente manufactura de jabón. Este proceso consiste en la hidrólisis alcalina, o en medio fuertemente básico, de los ésteres de los ácidos grasos tales como los que se consiguen en las grasas y en los aceites comestibles.
La saponificación se conoce desde hace siglos. En un principio se utilizó para determinar la composición de algunos triglicéridos comunes, tales como la estearina.
El químico que descubrió la reacción por primera vez, la utilizó para demostrar que la estearina en realidad no era más que la unión entre un alcohol, en este caso la glicerina o glicerol, con tres moléculas de un ácido graso denominado ácido esteárico.
Reacción de saponificación
La saponificación es una reacción de hidrólisis de un éster de ácido graso. Esto significa que el enlace del éster se rompe (lisis – rompimiento) por medio de la acción del agua (hidro – agua). Para ello se requiere el uso de una base fuerte como el hidróxido de sodio o el hidróxido de potasio.
Como productos se obtienen una sal del ácido (la cual es el jabón propiamente dicho) y un alcohol, tal como se muestra a continuación:

Mecanismo de la reacción de saponificación
El mecanismo de esta reacción es un proceso de tres pasos, que comienza con un ataque del ion hidróxido, luego la eliminación del alcohol y finalmente la formación de la sal.
Paso 1: Ataque del ion hidróxido
El primer paso, y la razón por la que se necesita agregar hidróxido de sodio o alguna otra base fuerte es el ataque del ion hidróxido al éster:

Paso 2: Eliminación del alcohol en forma de un ion alcóxido
En esta etapa, el par de electrones del oxígeno empuja al alcohol y lo separa del éster en forma de un ion alcóxido. Este ion es una base muy fuerte. Además del alcóxido, también se forma una molécula de ácido carboxílico (que es un ácido graso).

Paso 3: Formación de la sal
El ion alcóxido que se forma en la etapa anterior es una base muy fuerte y fácilmente le quita el protón al ácido carboxílico. Al hacerlo, convierte al ácido en un anión que, junto con el sodio del hidróxido original forma la sal de ácido graso, es decir, el jabón.

Saponificación de triglicéridos
En general, la reacción de saponificación se lleva a cabo con grasas o aceites bien sean vegetales o animales.

Los ésteres que están presentes en dichas grasas y aceites, casi siempre son triglicéridos o ésteres de ácidos grasos con un alcohol especial que se llama glicerol o glicerina.
En estos casos, la reacción de saponificación se ve así:

R1, R2 y R3 representan las cadenas del ácido graso. Como existen muchos ácidos grasos diferentes, la saponificación puede dar como producto jabones diferentes con propiedades diferentes.
Productos de la saponificación
Dependiendo del aceite o grasa de partida y de cuál base se utilice, se obtendrán jabones con distintas propiedades.
- Por ejemplo, el uso de hidróxido de sodio o de potasio dará como producto una sal de sodio o una sal de potasio (un jabón de sodio o de potasio). En general, los jabones de potasio tienen menor punto de fusión que los de sodio, y algunos incluso son líquidos a temperatura ambiente.
Así mismo, las características del ácido graso que forma parte del éster también afectarán las propiedades del jabón resultante. Mientras más larga sea la cadena, mayor será su punto de fusión.
Por esta razón, cuando se desea preparar jabones líquidos, por ejemplo, se seleccionan ácidos grasos con cadenas más cortas y se hidrolizan con hidróxido de potasio en lugar de sodio.
Importancia de la saponificación
La saponificación es una reacción de mucha importancia.
- A nivel industrial, es la reacción que se utiliza para la fabricación de todos los jabones de pasta, tales como los jabones de mano o los jabones de barra para lavar ropa.
- Por otro lado, también se utiliza frecuentemente como el primer paso en la obtención de ácidos grasos, los cuales luego son utilizados en una gran variedad de industrias tales como en la fabricación de cosméticos.
- En otros casos, los ácidos grasos se suelen utilizar como solventes o agentes dispersantes en la fabricación de pinturas, aunque es más común conseguir aceites minerales en estos casos.
- Además de esto, esta reacción también se utiliza para limpiar cualquier superficie grasienta tal como el interior de los hornos o la superficie de las cocinas.
En aquellos casos en los que las grasas están muy pegadas a la superficie o están carbonizadas y no se disuelven apropiadamente con ningún jabón o detergente, se les suele agregar una solución concentrada de hidróxido de sodio para llevar a cabo la reacción de saponificación directamente en la grasa. De esta forma, la grasa se convierte en jabón, el jabón se disuelve en agua y la superficie queda limpia.
Ejemplos de reacciones de saponificación
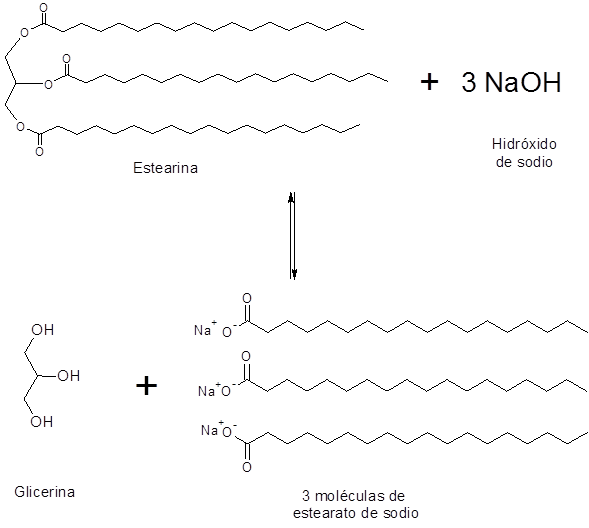
Saponificación de la estearina
La estearina es un triglicérido que contiene tres moléculas de ácido esteárico unidas a la glicerina. Su saponificación produce tres moléculas de jabón, en este caso estearato de sodio o potasio.
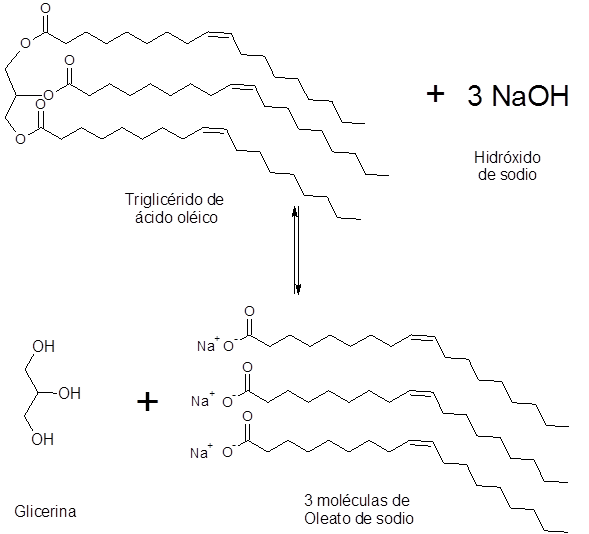
Saponificación del ácido oleico
Los aceites de oliva y girasol contienen más de 80% de ácido oleico. Este es una grasa insaturada que posee cadenas de 18 carbonos. La saponificación de estos aceites produce, entre otras cosas, oleato de sodio.
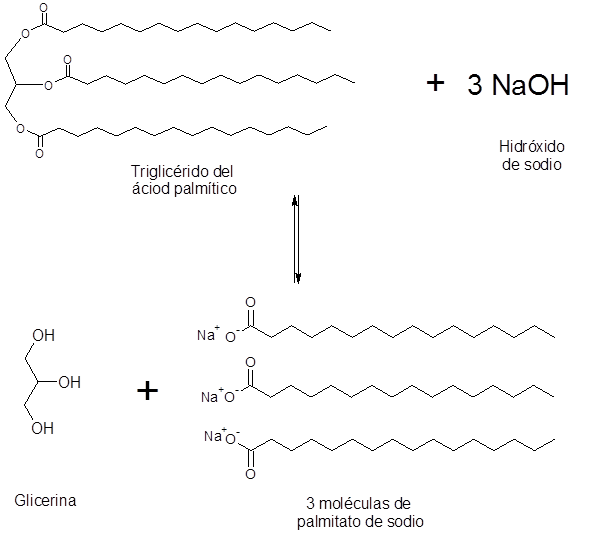
Saponificación del ácido palmítico
El ácido palmítico es un ácido graso saturado de cadena larga que contiene 16 átomos de carbono. Este es el ácido graso más importante de la dieta del ser humano. Es el principal ácido graso saturado que se encuentra en nuestro cuerpo.
En los alimentos, el ácido palmítico es uno de los principales componentes de la grasa animal, por lo que los jabones preparados a partir de grasas como la manteca de ganado vacuno, contienen principalmente palmitato de sodio o de potasio.
Además, el ácido palmítico forma más del 40% del aceite de palma (de allí su nombre). De hecho, la saponificación del aceite de palma es la principal fuente industrial de ácido palmítico a nivel mundial.