Calor de evaporación: qué es, fórmula, cálculo, aplicaciones, ejemplos

¿Qué es el calor de evaporación?
El calor de evaporación, también llamado calor de vaporización, se define como la cantidad de calor que una sustancia química pura absorbe para evaporarse, es decir, para sufrir un cambio de estado desde el estado líquido al estado gaseoso.
Es decir, se trata del calor asociado al siguiente proceso de cambio de fase:
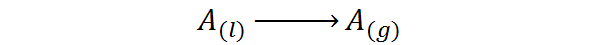
Es un tipo de calor que no genera un aumento en la temperatura, sino que rompe las fuerzas que mantienen juntas a las moléculas del líquido entre sí. De esta manera, se logra separar a las moléculas unas de otras, liberándolas a la fase gaseosa.
Fórmula y unidades
El calor de evaporación o de vaporización se puede representar por medio del símbolo Qvap. Es una cantidad extensiva, es decir, que depende de la cantidad de sustancia.
En este sentido, se puede calcular a partir de la cantidad de sustancia y de una medida intensiva del calor de evaporación.
Cuando la cantidad de sustancia se expresa en forma de masa, se debe utilizar el calor latente de evaporación o vaporización, Lvap, en cuyo caso el calor de evaporación queda expresado como:
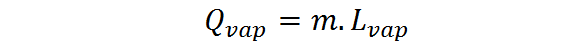
El calor latente de vaporización es una cantidad intensiva y característica de cada sustancia. Es una medida más o menos directa de qué tan fuertes son las interacciones intermoleculares entre las partículas que conforman un líquido.
Por otro lado, el calor de vaporización también se puede calcular a partir del número de moles, en cuyo caso se necesita el calor molar de vaporización, también llamado entalpía de vaporización:
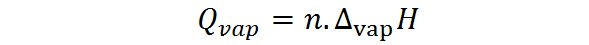
Donde n representa el número de moles y ∆vapH es la entalpía de vaporización de la sustancia. La entalpía de vaporización representa la cantidad de calor a presión constante que se necesita para evaporar un mol de una sustancia.
Unidades del calor de evaporación
Al tratarse de un tipo de calor, que es una forma de energía, el calor de evaporación se expresa en unidades de energía. Las unidades más comúnmente utilizadas son:
- Calorías (cal)
- Kilocalorías (kcal o cal)
- Jouls o Julios (J)
- Kilojouls o kilojulios (kJ), etc.
Por su lado, el calor latente de evaporación (Lvap) se expresa en unidades de energía sobre masa. Por ejemplo:
- cal/g
- Kcal/g
- Kcal/kg
- kJ/g
- kJ/kg, etc.
Finalmente, la entalpía de vaporización (∆vapH) se expresa en unidades de energía sobre unidades de cantidad de materia, generalmente moles. Algunos ejemplos son:
- cal/mol
- Kcal/mol
- J/mol
- kJ/mol, etc.
¿Cómo se calcula el calor de evaporación?
Como vimos hace un momento, el calor de evaporación se puede calcular a partir de la masa o el número de moles y el calor latente de evaporación o la entalpía de vaporización, respectivamente.
Sin embargo, estas cantidades por lo general se determinan midiendo experimentalmente la cantidad de calor necesaria para evaporar determinada masa de una sustancia y luego despejando alguna de las dos ecuaciones anteriores.
Debido a lo anterior, lo común no es que se calcule el calor de vaporización, sino que se mida experimentalmente, en el laboratorio.
Por otro lado, dado que la entalpía como propiedad termodinámica de un sistema es una función de estado, esta se puede calcular a partir de otras entalpías que relacionan a una sustancia en estado líquido con la misma sustancia en estado gaseoso.
Por ejemplo, se puede calcular la entalpía de vaporización restando la entalpía de sublimación menos la entalpía de fusión de una sustancia. Luego, esta entalpía y el número de moles se utilizan para determinar el calor de evaporación de la muestra.
Aplicaciones del calor de evaporación
Son muchos los campos en los que se utiliza el calor de evaporación. De hecho, en cualquier proceso que involucre a una sustancia química que en un momento esté en estado líquido y en otro en estado gaseoso, intervendrá el calor de evaporación.
El calor de evaporación siempre es positivo, ya que siempre se necesita absorber calor para poder romper la unión entre las moléculas que forman un líquido. La sustancia absorbe este calor de los alrededores inmediatos, por lo que estos pierden calor cuando un líquido se evapora.
El calor de evaporación y la regulación de la temperatura corporal
Este es el principio de funcionamiento de la sudoración como sistema de regulación de la temperatura corporal.
Cuando sudamos, el agua del sudor se evapora en la superficie de nuestra piel. Como la piel está en contacto directo con el sudor, es de allí de donde el agua obtiene el calor de evaporación.
Entonces, al evaporarse, el agua del sudor se lleva consigo una cantidad de calor de la piel, con lo que esta se enfría, enfriando también la sangre que fluye por los capilares de la piel y, en último término, el interior del cuerpo.
El calor de evaporación en la industria
La energía es uno de los mayores costos para muchas industrias, y muchas de ellas requieren gastar energía para evaporar distintas sustancias. Por esta razón, poder calcular la cantidad de calor requerida para evaporar distintos líquidos es necesario para así poder calcular costos de operación.
Por ejemplo, si una empresa farmacéutica sintetiza un medicamento en una solución alcohólica, probablemente tendrá que evaporar y secar el producto para eliminar todo el alcohol. El calor de evaporación permite determinar cuánta energía se requerirá para llevar esto a cabo.
Fabricación de hielo en un tren
Antes de la existencia de la electricidad, los trenes utilizaban el calor de evaporación para congelar agua y así fabricar hielo durante el viaje. El proceso es similar al de la sudoración y funciona de la misma manera.
En la estación, el tren engancha una bolsa de cuero que contiene agua líquida. La bolsa no es perfectamente hermética, así que el exterior se humedece. Durante el viaje, el aire evapora rápidamente el agua de la superficie de la bolsa, absorbiendo calor del agua líquida y enfriándola, hasta el punto de congelarla.
Ejemplos de calores de evaporación
La siguiente tabla contiene los calores latentes de vaporización o de evaporación para algunas sustancias químicas comunes.
| Sustancia | Calor latente de vaporización (Lvap/kJ.g-1) | Entalpía de vaporización (∆vapH/kJ.mol-1) |
| Agua (H2O) | 2,260 | 40,657 |
| Etanol (CH3CH2OH) | 0,837 | 38,56 |
| Sulfuro de hidrógeno (H2S) | 0,6422 | 21,90 |
Referencias
- EHU.ES (s. f.). Calor latente de vaporización del agua. Tomado de sc.ehu.es.
- Luz, G. (s. f.). Calor de Vaporización. Tomado de materiales.gelsonluz.com.
- Soler&Palau (2019). Calor latente: fusión y vaporización. Tomado de solerpalau.com.
- Spiegato (2021). ¿Qué es el calor de vaporización? Tomado de spiegato.com.
