Electrófilo: reacciones, ejemplos, electrofilicidad
Un electrófilo es toda aquella especie química (átomo o molécula) que busca ávidamente un par de electrones. La palabra quiere decir ‘amor por los electrones’. Por lo tanto, un electrófilo siempre tenderá a ganar o aceptar electrones cuando participa en las reacciones químicas.
¿Qué hace que un electrófilo esté necesitado de electrones? Debe poseer una deficiencia de electrones, ya sea manifestada por una carga positiva parcial o total, o por una vacancia electrónica producto de un octeto de valencia incompleto. Es decir, tenemos varios tipos de electrófilos, aunque todos ellos aceptan pares de electrones de especies negativas.
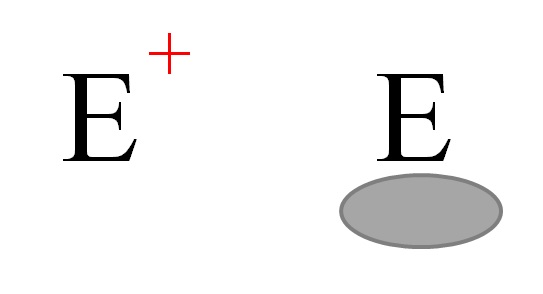
Arriba se representan de manera general dos tipos de electrófilos. Ambos se simbolizan con la letra E. El de la izquierda corresponde a un electrófilo de carga positiva, E+. Mientras, el de la derecha corresponde a un electrófilo con vacancia electrónica, representada por un óvalo grisáceo que indica la ausencia de electrones en un orbital de valencia.
Los cationes metálicos son ejemplos de electrófilos E+, así como algunos iones poliatómicos como el hidronio, H3O+. Las moléculas de AlH3 y BF3, por otro lado, son ejemplos del segundo tipo de electrófilos, pues tanto el átomo de aluminio como el de boro tienen una deficiencia de electrones debido a que no completan el octeto de valencia.
Índice del artículo
Los electrófilos reaccionan aceptando pares de electrones de átomos con altas densidades negativas, es decir, ricos en electrones. Estos átomos o moléculas negativas reciben el nombre de nucleófilos, Nu–, los cuales donan un par de electrones hacia el electrófilo E o E+:
Nu– + E+ → Nu-E
Esta es la base teórica para muchas reacciones orgánicas, tales como la sustitución electrofílica aromática. El nucleófilo no necesariamente tiene que tratarse de un anión, sino que puede también ser una molécula neutra con un átomo electronegativo, como el nitrógeno.
Los ácidos de Lewis son electrófilos, pues por definición aceptan pares de electrones. Los cationes metálicos, Mn+, atraen las regiones negativas de las moléculas polares aledañas en los procesos de solvatación. Así, Mn+ termina rodeándose de cargas negativas, llegando inclusive a aceptar electrones para formar complejos de coordinación.
El catión Cu2+, por ejemplo, es un ácido de Lewis y un electrófilo porque se coordina con los átomos de oxígenos del agua para formar un acuo complejo, Cu(OH2)62+. Del mismo modo sucede con otros cationes.
No todos los ácidos de Lewis son cationes: algunos son moléculas o átomos neutros. Por ejemplo, el BF3 es un ácido de Lewis y un electrófilo porque busca aceptar los electrones de especies negativas cercanas para completar su octeto de valencia.
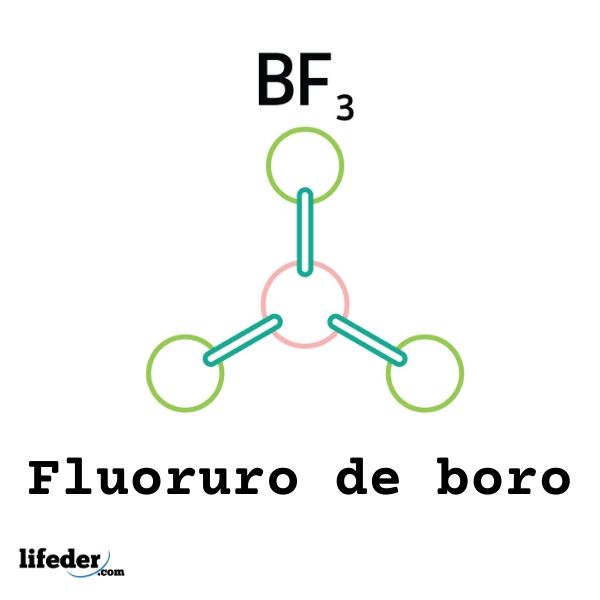
Así, se enlazará a un anión fluoruro aledaño para formar el anión tetrafluoruro de boro, BF4–. Es decir, el BF3 forma un enlace con el F– mediante la aceptación de un par de sus electrones.
Otro electrófilo es el ion nitronio, NO2+, el cual es un agente electrofílico muy fuerte formado en las reacciones de nitración del benceno. En ese ion el átomo de nitrógeno tiene una carga positiva, por lo que acepta rápidamente los electrones del benceno.
Algunos ácidos de Brönsted también son electrófilos. Por ejemplo, el catión hidronio, H3O+, es un electrófilo porque el átomo de oxígeno tiene una carga positiva. Al ser muy electronegativo, buscará ganar electrones donando uno de sus hidrógenos para transformarse en una molécula de agua.
Otro ácido de Brönsted como el ácido sulfúrico, H2SO4, también es un electrófilo. El átomo de azufre se encuentra altamente oxidado, y buscará ganar electrones donando sus dos hidrógenos.
Los halógenos (F2, Cl2, Br2 y I2) son electrófilos. Sus átomos no presentan deficiencias electrónicas; sin embargo, sus enlaces son inestables, pues ambos átomos, X-X, atraen con mucha fuerza los electrones hacia ellos.
Por lo tanto, los halógenos reaccionan como agentes oxidantes, comportándose como electrófilos y aceptando pares de electrones para convertirse en aniones halogenuros (F–, Cl–, Br– y I–).
No obstante, los halógenos no solo ganan electrones de este modo. También pueden enlazarse con átomos menos electronegativos que ellos para así obtener una ganancia neta de electrones. Por ejemplo, esta es la razón por la cual se pueden adicionar a los dobles enlaces de los alquenos u olefinas.
Los halógenos representan un tipo de electrófilo diferente a los dos que se introdujeron al comienzo. No obstante, su comportamiento al final es el mismo que para todos los electrófilos: aceptar pares de electrones.

Los haluros de alquilo y de hidrógeno son electrófilos en los que el átomo enlazado al halógeno presenta una fuerte deficiencia electrónica representada por el símbolo δ+. Esto se debe a que el halógeno, altamente electronegativo, atrae la densidad electrónica del átomo vecino hacia sí.
Para los haluros de alquilo, RX, R tendrá una deficiencia electrónica mientras X un exceso de electrones, Rδ+-Xδ-. Así, si una especie muy negativa se aproxima a RX, atacará a R para enlazarse con él y hacer que salga X como un anión.
Asimismo, en los haluros de hidrógeno, HX, el hidrógeno tiene una deficiencia electrónica o una carga parcial positiva, Hδ+-Xδ-. Por lo tanto, las especies negativas cederán sus electrones a este hidrógeno y él, como electrófilo, los aceptará.
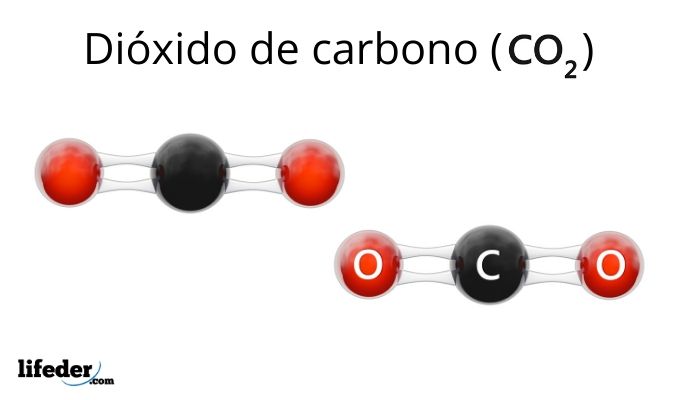
Los ácidos, los halógenos y los haluros no son las únicas moléculas que pueden clasificarse como electrófilos. Aunque no lo parezca, el dióxido de carbono, CO2, es un electrófilo, pues el átomo de carbono central se encuentra muy oxidado, O=Cδ+=O.
Por lo tanto, cuando el CO2 reacciona lo hará aceptando pares de electrones, ya sea convirtiéndose en el grupo carboxilato, COOH, o en el anión carbonato, CO32-.
Además del CO2, los compuestos carbonílicos, como las cetonas, aldehídos y ésteres también son ejemplos de electrófilos, pues en ellos el carbono tiene carga parcial positiva y tiende a aceptar electrones de especies muy negativas.
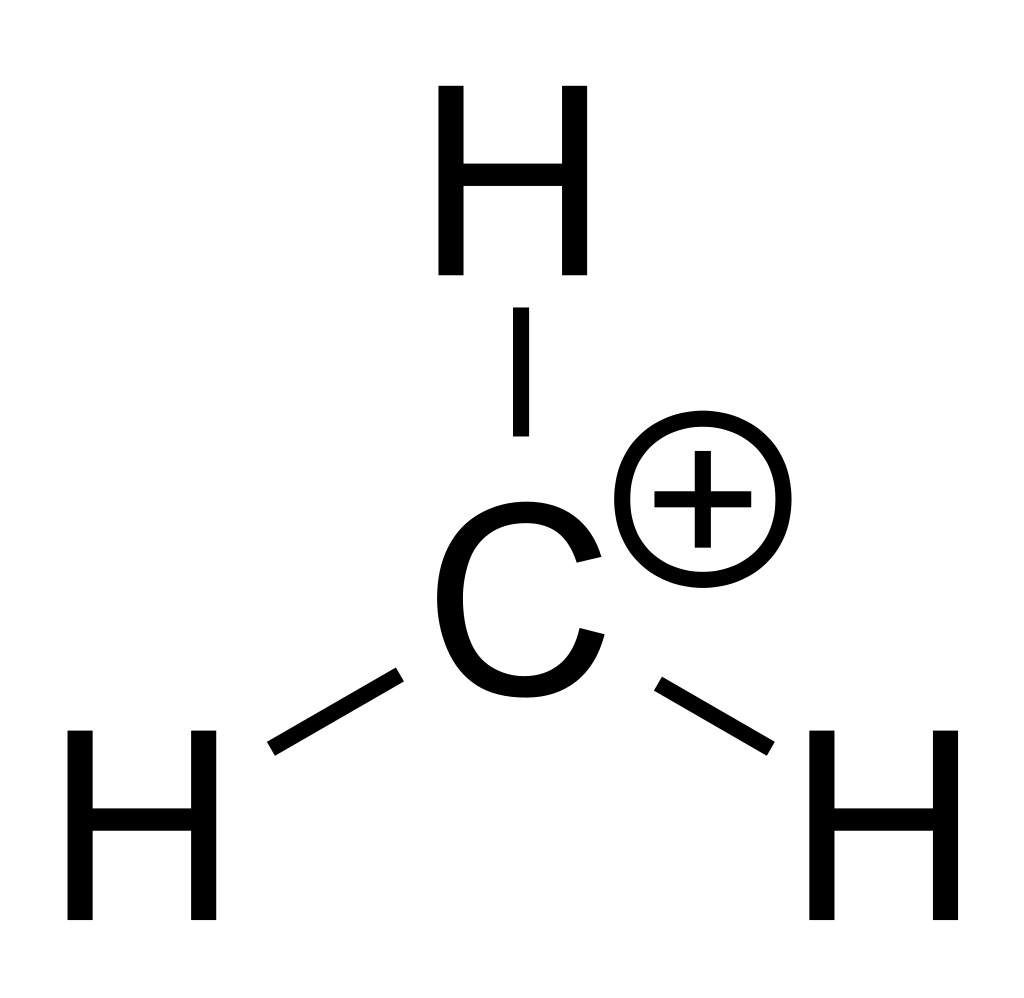
Los carbocationes son ácidos de Lewis extraordinariamente fuertes. Los hay terciarios (R3C+), secundarios (R2HC+) o primarios (RH2C+). El carbono siempre forma cuatro enlaces, por lo que este catión en particular buscará cómo aceptar electrones de cualquier manera.
No todos los electrófilos están igual de “hambrientos” por los electrones. Algunos son más reactivos que otros. Mientras más grande sea la deficiencia electrónica de un electrófilo, mayor será su sensibilidad a sufrir ataques nucleofílicos de especies negativas. Es decir, presentará mayor electrofilicidad, que es la medida relativa de cuán reactivo es el electrófilo en cuestión.
Por ejemplo, los carbocationes, el nitronio y el flúor poseen una alta electrofilicidad; mientras que el dióxido de carbono o algunos cationes como el sodio, presentan baja electrofilicidad.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Morrison, R. T. y Boyd, R, N. (1987). Química Orgánica. 5ta Edición. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. (10th edition.). Wiley Plus.
- Wikipedia. (2020). Electrophile. Recuperado de: en.wikipedia.org
- James Ashenhurst. (2020). Nucleophiles and Electrophiles. Recuperado de: masterorganicchemistry.com
- Professor Patricia Shapley. (2012). Nucleophiles and Electrophiles. University of Illinois. Recuperado de: butane.chem.uiuc.edu
- Danielle Reid. (2020). Electrophile: Definition & Examples. Study. Recuperado de: study.com
- Tim Soderberg. (07 de octubre de 2019). Electrophiles. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
