Óxido de cerio (IV): estructura, propiedades, usos
El óxido de cerio (IV) u óxido cérico es un sólido inorgánico blanco o amarillo pálido que se produce por la oxidación del cerio (Ce) por el oxígeno hasta su valencia 4+. La fórmula química del óxido cérico es CeO2 y es el óxido más estable del cerio.
El cerio (Ce) es un elemento de la serie de los lantánidos, los cuales están incluidos en el grupo de las tierras-raras. Fuente natural de este óxido es el mineral bastnasita. En el concentrado comercial de este mineral el CeO2 se puede encontrar en una proporción aproximada de hasta 30% en peso.

El CeO2 se puede obtener fácilmente mediante el calentamiento en aire u oxígeno del hidróxido de cerio (III), Ce(OH)3, o de cualquier sal de cerio (III), como el oxalato, carbonato o nitrato.
El CeO2 estequiométrico se puede obtener mediante reacción a temperatura elevada del óxido de cerio (III) con oxígeno elemental. El oxígeno debe estar en exceso y se debe dejar suficiente tiempo para completar la conversión de las varias fases no-estequiométricas que se van formando.
Estas fases comprenden productos multicolores de fórmula CeOx (donde x varía entre 1,5 y 2,0). También se denominan CeO2-x, donde x puede tener un valor de hasta 0,3. El CeO2 es la forma de Ce más ampliamente usada en la industria. Posee una baja clasificación de toxicidad, especialmente por su pobre solubilidad en agua.

Índice del artículo
El óxido de cerio (IV) estequiométrico cristaliza en la red cúbica tipo fluorita (CaF2), con 8 iones O2- en una estructura cúbica coordinados con 4 iones Ce4+.
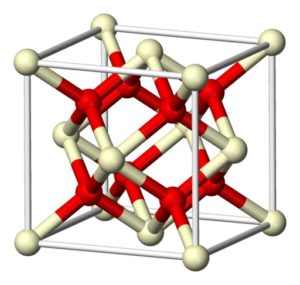
– Óxido de cerio (IV).
– Óxido cérico.
– Dióxido de cerio.
– Ceria.
– Óxido de cerio estequiométrico: material formado totalmente por CeO2.
– Óxido de cerio no-estequiométrico: material formado por óxidos mezclados desde el CeO2 hasta el CeO1,5
Sólido amarillo pálido. El color es sensible a la estequiometría y a la presencia de otros lantánidos. Los óxidos no estequiométricos a menudo son azules.
6-6,1 aproximadamente.
172,12 g/mol.
2600 ºC aproximadamente.
7,132 g/cm3
Insoluble en agua fría y caliente. Soluble en ácido sulfúrico concentrado y ácido nítrico concentrado. Insoluble en ácidos diluidos.
2,2.
El CeO2 es una substancia inerte, no es atacado ni por ácidos fuertes ni álcalis. Sin embargo, puede ser disuelto por ácidos en presencia de agentes reductores, como agua oxigenada (H2O2) o estaño (II), entre otros, generando soluciones de cerio (III).
Presenta alta estabilidad térmica. No sufre cambios cristalográficos durante intervalos usuales de calentamiento.
Su derivado hidratado (CeO2.nH2O) es un precipitado amarillo y gelatinoso que se obtiene al tratar soluciones de cerio (IV) con bases.
El CeO2 es pobremente absorbido por el tracto gastrointestinal por lo que no tiene efectos tóxicos.
El CeO2 se emplea en los electrodos de ciertas tecnologías de soldadura, como la soldadura por arco de tungsteno con gas inerte.
El óxido se encuentra finamente disperso en toda la matriz del tungsteno. A voltajes bajos estas partículas de CeO2 dan una mayor fiabilidad que el tungsteno solo.
Pulido de vidrio
El óxido de cerio es el agente de pulido más eficiente para la mayoría de las composiciones comerciales de vidrio. El CeO2 ha reemplazado casi completamente a otros óxidos de pulido, como el Fe2O3, la sílice, y el ZrO2, debido a su mayor velocidad de pulido y su limpieza, las cuales aumentan al aumentar el grado de pureza del óxido.
Los pulimentos comerciales para vidrio basados en polvos de óxido de cerio tienen tamaños de partícula definidos y dispersabilidad controlada en sistemas acuosos.
El proceso de pulido del vidrio requiere agua y lo que se remueve o reforma es una capa superficial hidratada más suave. El agente de pulido debe tener una dureza Mohs de aproximadamente 6,5, cercana a la dureza de la mayoría de los vidrios.
El óxido de cerio en agua contiene la pareja Ce (IV) / Ce(III) que con sus reacciones de óxido-reducción puede proporcionar asistencia química durante la ruptura de la red de silicato del vidrio.
El CeO2 con alto grado de pureza se emplea para tratar espejos, placas de aparatos de televisión, lentes oftálmicos y material óptico de precisión.
Decoloración de vidrio
El CeO2 puede decolorar vidrios de soda-cal para botellas, jarras y similares. El Ce (IV) oxida las impurezas de Fe (II), que proporcionan color verde-azulado, a Fe (III) que confiere un color amarillo 10 veces más débil.
Vidrio resistente a la radiación
La adición de 1% de CeO2 al vidrio suprime la decoloración u oscurecimiento del vidrio causada por el bombardeo de electrones de alta energía en vidrios de TV. Lo mismo ocurre en vidrios usados en ventanas en celdas calientes de la industria nuclear, ya que suprime la decoloración inducida por los rayos gamma.
Se cree que el mecanismo de supresión depende de la presencia de iones Ce4+ y Ce3+ en la red del vidrio.
Vidrios fotosensibles
Algunas formulaciones de vidrio pueden desarrollar imágenes latentes que luego pueden ser convertidas a una estructura o color permanente.
Este tipo de vidrio contiene CeO2 que absorbe la radiación UV y libera electrones en la matriz de vidrio.
Mediante tratamiento posterior se genera el crecimiento de cristales de otros compuestos en el vidrio, creando patrones detallados para usos electrónicos o decorativos.
Por su alto índice de refracción el CeO2 es un agente de opacidad en composiciones de esmaltes usadas como recubrimientos protectores sobre metales.
Su alta estabilidad térmica y su forma cristalográfica única a lo largo de todo el intervalo de temperaturas que se alcanzan durante el proceso de esmaltado, lo hacen adecuado para su uso en esmaltes para porcelanas.
En esta aplicación el CeO2 proporciona la deseada cubierta blanca durante el quemado del esmalte. Es el ingrediente que provee opacidad.
La cerámica de circonio es un aislante térmico y se emplea en aplicaciones de alta temperatura. Requiere un aditivo para poseer alta resistencia y tenacidad. Agregando CeO2 a óxido de circonio se produce un material con excepcional tenacidad y buena resistencia.
El óxido de circonio dopado con CeO2 se usa en recubrimientos para actuar como barrera térmica sobre superficies metálicas.
Por ejemplo, en las partes de motores de aeronaves estos recubrimientos protegen de las altas temperaturas a las cuales los metales estarían expuestos.
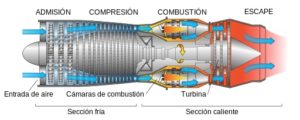
El CeO2 es un componente activo en la remoción de contaminantes de las emisiones de los vehículos. Esto se debe en gran parte a su capacidad para almacenar o liberar oxígeno dependiendo de las condiciones que lo rodean.
El convertidor catalítico de los vehículos automotores está ubicado entre el motor y la salida de los gases de escape. Posee un catalizador que debe oxidar hidrocarburos no-quemados, convertir CO a CO2, y reducir los óxidos de nitrógeno, NOx, a N2 y O2.

Además de platino y otros metales catalíticos, el principal componente activo de estos sistemas multifuncionales es el CeO2.
Cada convertidor catalítico contiene 50-100 g de CeO2 finamente dividido, el cual cumple varias funciones. Las más importantes son:
Actúa como estabilizador de la alúmina de alta área superficial
La alúmina de alta área superficial tiende a sinterizar, perdiendo su alta área superficial durante la operación a altas temperaturas. Esto es retardado por la presencia de CeO2.
Se comporta como un almacenador-liberador de oxígeno
Por su capacidad de formar óxidos no-estequiométricos CeO2-x, el óxido de cerio (IV) proporciona oxígeno elemental de su propia estructura durante el periodo del ciclo pobre en oxígeno/rico en combustible.
Así, puede continuar la oxidación de hidrocarburos no quemados que provienen del motor y la conversión de CO en CO2, aun cuando es insuficiente el oxígeno gaseoso.
Luego, en el periodo del ciclo rico en oxígeno, retoma el oxígeno y se vuelve a oxidar, recuperando su forma estequiométrica CeO2.
Otros
Funciona como mejorador de la capacidad catalítica del rodio en la reducción de los óxidos de nitrógeno NOx a nitrógeno y oxígeno.
En los procesos de craqueo catalítico de las refinerías el CeO2 actúa como un oxidante catalítico que ayuda en la conversión de SO2 a SO3 y promueve la formación de sulfatos en trampas específicas del proceso.
El CeO2 mejora la actividad del catalizador basado en óxido de hierro que se emplea en la obtención del estireno partiendo del etilbenceno. Esto se debe posiblemente a la interacción positiva entre las parejas de óxido-reducción de Fe (II) – Fe (III) y Ce (III) – Ce (IV).
Se ha encontrado que las nanopartículas de CeO2 actúan eliminando radicales libres, tales como el superóxido, peróxido de hidrógeno, hidroxilo y radical de óxido nítrico.
Pueden proteger los tejidos biológicos del daño inducido por radiación, daño de la retina inducido por láser, aumentan el rango de vida de las células fotoreceptoras, reducen las lesiones espinales, reducen la inflamación crónica y promueven la angiogénesis o formación de vasos sanguíneos.
Adicionalmente, ciertas nanofibras que contienen nanopartículas de CeO2 han demostrado ser tóxicas contra cepas bacterianas, siendo candidatas prometedoras para aplicaciones bactericidas.
El CeO2 es un material aislante eléctrico debido a su excelente estabilidad química, permitividad relativa alta (tiene alta tendencia a polarizarse ante la aplicación de un campo eléctrico) y red cristalina similar al silicio.
Ha encontrado aplicación en condensadores y capas de amortiguación de materiales superconductores.
Es usado también en sensores de gas, materiales para electrodos de celdas de combustible de óxido sólido, bombas de oxígeno y monitores de oxígeno.
- Cotton, F. Albert and Wilkinson, Geoffrey. (1980). Advanced Inorganic Chemistry. Fourth Edition. John Wiley & Sons.
- Bailar, J.C.; Emeléus, H.J.; Sir Ronald Nyholm and Trotman-Dickenson, A.F. (1973). Comprehensive Inorganic Chemistry. Volume 4. Pergamon Press.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Volume 5. Fourth Edition. John Wiley & Sons.
- Ullmann’s Encyclopedia of Industrial Chemistry. (1990). Fifth Edition. Volume A6. VCH Verlagsgesellschaft mbH.
- Casals, Eudald et al. (2012). Analysis and Risk of Nanomaterials in Environmental and Food Samples. In Comprehensive Analytical Chemistry. Recuperado de sciencedirect.com.
- Mailadil T. Sebastian. (2008). Alumina, Titania, Ceria, Silicate, Tungstate and other materials. In Dielectric Materials for Wireless Communication. Recuperado de sciencedirect.com.
- Afeesh Rajan Unnithan, et al. (2015). Scaffolds with Antibacterial Properties. In Nanotechnology Applications for Tissue Engineering. Recuperado de sciencedirect.com.
- Gottardi V., et al. (1979). Pulido de la superficie de un vidrio investigado con una técnica nuclear. Boletín de la Sociedad Española de Cerámica y Vidrio, Vol. 18, No. 3. Recuperado de boletines.secv.es.
