Óxido de oro (III)(Au2O3): estructura, propiedades y usos
El óxido de oro (III) es un compuesto inorgánico cuya fórmula química es Au2O3. Teóricamente podría esperarse que su naturaleza fuera del tipo covalente. Sin embargo, no puede descartarse del todo la presencia de cierto carácter iónico en su sólido; o lo que es igual, asumir la ausencia del catión Au3+ junto al anión O2-.
Quizás parezca contradictorio que el oro, siendo un metal noble, pueda oxidarse. En condiciones normales, las piezas de oro (como las estrellas de la imagen inferior) no pueden oxidarse por contacto con el oxígeno de la atmósfera; sin embargo, cuando son irradiadas con radiación ultravioleta en presencia de ozono, O3, el panorama es otro.
Si las estrellas de oro se sometieran a estas condiciones, se tornarían de un color marrón rojizo, característico del Au2O3.
Otros métodos para obtener este óxido implicarían el tratamiento químico de dichas estrellas; por ejemplo, convirtiendo la masa de oro en su respectivo cloruro, AuCl3.
Después, al AuCl3, y el resto de las posibles sales de oro formadas, se le adiciona un medio básico fuerte; y con esto, se obtiene el óxido hidratado o hidróxido, Au(OH)3. Finalmente, este último compuesto se deshidrata térmicamente para obtener así el Au2O3.
Índice del artículo
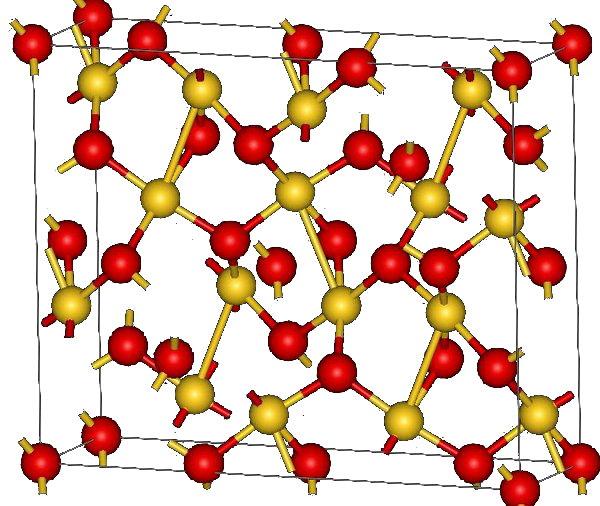
En la imagen superior se muestra la estructura cristalina del óxido de oro (III). Se muestra la disposición de los átomos de oro y oxígeno en el sólido, ya sea considerándolos átomos neutros (sólido covalente), o iones (sólido iónico). Indistintamente, basta con eliminar o colocar los enlaces Au-O en cualquier caso.
De acuerdo a la imagen, se asume que el carácter covalente predomina (lo cual sería lógico). Por esa razón, se muestran los átomos y enlaces representados con esferas y barras, respectivamente. Las esferas doradas corresponden a los átomos de oro (AuIII-O), y las rojizas a los átomos de oxígeno.
Si se observa detenidamente, se verá que existen unidades AuO4, las cuales se unen mediante átomos de oxígeno. Otra manera de visualizarlo sería considerar que cada Au3+ está rodeado de cuatro O2-; claro está, desde una perspectiva iónica.
Esta estructura es cristalina debido a que los átomos se ordenan obedeciendo un mismo patrón a largo alcance. Siendo así, su celda unitaria corresponde al sistema cristalino romboédrico (el mismo de la imagen superior). Por lo tanto, todo el Au2O3 podría construirse si se distribuyera en el espacio todas esas esferas de la celda unitaria.
El oro es un metal de transición, y es de esperarse que sus orbitales 5d interaccionen directamente con los orbitales 2p del átomo de oxígeno. Este solapamiento de sus orbitales teóricamente debe generar bandas de conducción, que convertirían al Au2O3 en un sólido semiconductor.
Por lo tanto, la verdadera estructura del Au2O3 es aún más compleja teniendo esto en mente.
El óxido de oro puede retener moléculas de agua dentro de sus cristales romboédricos, lo cual da lugar a los hidratos. Al formarse tales hidratos, la estructura se torna amorfa, es decir, desordenada.
La fórmula química para tales hidratos puede ser cualquiera de las siguientes, las cuales de hecho no están profundamente esclarecidas: Au2O3∙zH2O (z=1, 2, 3, etc.), Au(OH)3, o AuxOy(OH)z.
La fórmula Au(OH)3 representa una sobre simplificación de la verdadera composición de dichos hidratos. Esto se debe a que dentro del hidróxido de oro (III), investigadores han encontrado también la presencia de Au2O3; y por lo tanto, pierde sentido el tratarlo aisladamente como un “simple” hidróxido de metal de transición.
Por otro lado, de un sólido con fórmula AuxOy(OH)z podría esperarse una estructura amorfa; ya que, esta depende de los coeficientes x, y y z, cuyas variaciones darían lugar a todo tipo de estructura que difícilmente pudieran exhibir un patrón cristalino.
Es un sólido de color marrón rojizo.
441,93 g/mol.
11,34 g/mL.
Funde y se descompone a 160ºC. Carece por tanto de punto de ebullición, por lo que este óxido nunca alcanza a hervir.
El Au2O3 es termodinámicamente inestable debido a que, como se mencionó al principio, el oro no tiende a oxidarse en condiciones normales de temperatura. De manera que se reduce fácilmente para convertirse nuevamente en el noble oro.
Mientras mayor sea la temperatura, más rápida será dicha reacción, a la cual se le conoce como descomposición térmica. Así, el Au2O3 a 160ºC se descompone para producir oro metálico y liberar oxígeno molecular:
2 Au2O3 => 4 Au + 3 O2
Una reacción muy parecida puede darse con otros compuestos que favorecen dicha reducción. ¿Por qué reducción? Porque el oro vuelve a ganar los electrones que el oxígeno le quitó; lo que es igual a decir que pierde enlaces con el oxígeno.
Es un sólido insoluble en agua. Sin embargo, es soluble en ácido clorhídrico y ácido nítrico, debido a la formación de cloruros y nitratos de oro.
El óxido de oro (III) es el nombre regido por la nomenclatura stock. Otras maneras de mencionarlo son:
-Nomenclatura tradicional: óxido aúrico, debido a que la valencia 3+ es la mayor para el oro.
-Nomenclatura sistemática: trióxido de dioro.
Uno de sus usos más eminentes es el de aportar color rojizo a ciertos materiales, como los vidrios, además de conferirles ciertas propiedades inherentes a los átomos de oro.
Si se adiciona el Au2O3 a un medio donde es soluble, y en presencia de metales, puede precipitar tras la adición de una base fuerte los auratos; los cuales, están formados por aniones AuO4– en compañía de cationes metálicos.
Asimismo, el Au2O3 reacciona con amoníaco para formar el compuesto oro fulminante, Au2O3(NH3)4. Su nombre deriva del hecho de que es altamente explosivo.
Sobre el oro y su óxido no se adsorben del mismo modo ciertos compuestos, como los dialquil disulfuros, RSSR. Cuando ocurre esta adsorción, se forma espontáneamente un enlace Au-S, donde el átomo de azufre exhibe y define las características químicas de dicha superficie dependiendo del grupo funcional al que esté enlazado.
Los RSSR no pueden adsorberse sobre el Au2O3, pero sí sobre el oro metálico. Por lo tanto, si se modifica la superficie del oro y su grado de oxidación, así como el tamaño de las partículas o capas de Au2O3, puede diseñarse una superficie más heterogénea.
Esta superficie Au2O3-AuSR interacciona con los óxidos metálicos de ciertos dispositivos electrónicos, desarrollando así futuras superficies más inteligentes.
- Wikipedia. (2018). Gold(III) oxide. Recuperado de: en.wikipedia.org
- Formulación Química. (2018). Óxido de oro (III). Recuperado de: formulacionquimica.com
- D. Michaud. (24 de octubre de 2016). Gold oxides. 911 Metallurgist. Recuperado de: 911metallurgist.com
- Shi, R. Asahi y C. Stampfl. (2007). Properties of the gold oxides Au2O3 and Au2O: First-principles investigation. The American Physical Society.
- Cook, Kevin M. (2013). Gold Oxide as a Masking Layer for Regioselective Surface Chemistry. Theses and Dissertations. Paper 1460.
