Reacción de síntesis: tipos, factores, ejemplos
La reacción de síntesis es aquella en la que dos o más reactivos reaccionan para poder originar, cuantitativamente, uno o más productos, ya sea a escalas de laboratorio o a nivel industrial. Se trata de una de las reacciones más fundamentales de la química, y sus tipos y diseños bordean casi el infinito.
De forma genérica se puede representar con la forma: A+B→C. En una reacción de síntesis simple, un reactivo A reacciona con otro reactivo B, para producir un producto C. Se dice que consta de un solo paso. Sin embargo, puede ocurrir que A deba reaccionar primero con E, seguido de F, y finalmente con G (otros reactivos), para transformarse en el producto C; es decir, la misma reacción tiene lugar en múltiples pasos.

Sin importar que sea un solo paso o muchos, todas las reacciones de síntesis se basan en la efectividad (termodinámica y cinética) con que los reactivos reaccionan para transformarse en productos, así como también en el rendimiento experimental. Se desea que una reacción de síntesis transcurra exitosamente y produzca tanta cantidad de productos como sea posible.
Índice del artículo
- 1 Tipos de reacciones de síntesis
- 2 Factores que intervienen en las reacciones de síntesis
- 3 Ejemplos de reacciones de síntesis
- 4 Referencias
Las reacciones de síntesis no son del todo fáciles de clasificar. Puede ser un tema relativo al criterio del químico. ¿Por qué? Supóngase nuevamente la reacción múltiple comentada arriba:
A + E → P1
P1 + F → P2
P2 + G → C
Siendo P1 y P2 productos intermediarios que no son de interés. La reacción de síntesis del producto o compuesto C, partiendo de A como reactivo principal (reactivo límite o limitante), es múltiple o compleja, pues se da en varios pasos, en los que participan otros reactivos: E, F y G.
Cada una de las tres reacciones anteriores puede consistir e un tipo de reacción química en sí mismas. Es decir, una reacción de síntesis puede ser de cualquier otro tipo de reacciones químicas (doble desplazamiento, redox, combustión, neutralización, nitración, sustitución, etc.), siempre y cuando origine un producto y tenga asociada un rendimiento experimental.
Así:
A + E → P1
Puede verse como una reacción de síntesis simple para el producto P1, independientemente del tipo de reacción que sea. Y asimismo:
P1 + F → P2
Es otra reacción de síntesis simple para el producto P2.
Las reacciones de síntesis pueden ser de cualquier tipo en lo que respecta a la naturaleza de la reacción y a su mecanismo molecular. Sin embargo, estas pueden dividirse de acuerdo a la naturaleza química de los reactivos y de los productos.
Por ejemplo, si los reactivos son sustancias inorgánicas, entonces hablamos de síntesis inorgánicas; mientras que si fueran sustancias orgánicas, hablaríamos ya de síntesis orgánicas.
El campo de la síntesis orgánica es colosal, pues abarca las producciones de fármacos, colorantes, plásticos, insecticidas, adhesivos, perfumes, conservantes, entre miles de otros productos.
Los factores que intervienen en las reacciones de síntesis son todos aquellos parámetros o variables, físicos y químicos, que afectan directamente el rendimiento de la reacción y la calidad de los productos originados. Algunos de ellos son los siguientes:
La temperatura es primordial en toda reacción de síntesis. Dependiendo de su termodinámica, puede ser conveniente que se mantenga baja o alta. Asimismo, hay rangos de temperaturas donde es probable que se dé lugar reacciones laterales indeseables, por lo que es indispensable controlarla y verificarla a todo momento.
El tiempo también es primordial en las reacciones de síntesis, pues debe asegurarse que sea lo suficiente para garantizar el establecimiento del equilibrio. Transcurrido una determinada cantidad de tiempo, dejará de obtenerse más producto, y es allí cuando se decide detener la síntesis por completo.
Mientras más concentrados estén los reactivos, más rápidas serán las reacciones entre ellos. Sin embargo, es primordial además tener claro cuál será la proporción de sus concentraciones, así como sus magnitudes, ya que el mínimo cambio afectará el rendimiento final.
Por otro lado, los reactivos deben ser lo más puros posibles, pues de lo contrario se asumirán concentraciones erróneas; o peor aún, se contaminarán los productos, u ocurrirán reacciones indeseables.
El modo en que se agite el medio de reacción influirá en las rapideces de las reacciones de síntesis.
La presión, al igual que la concentración, juega un papel crucial, en especial cuando los reactivos son especies o sustancias gaseosas. Mientras mayor sea la presión, mayores serán las colisiones o interacciones entre los reactivos y, por lo tanto, habrá más probabilidades de que reaccionen.
El pH (ácido o básico) afecta directamente el mecanismo de una reacción, por lo que es un factor clave para definir qué productos se obtendrán al final de la síntesis.
Los catalizadores son sustancias que aceleran las reacciones químicas pero sin consumirse durante el proceso. Hay síntesis que sin su intervención resultaría imposible realizarlas con un rendimiento aceptable, o demorarían mucho tiempo en obtenerse los productos.
A continuación, y para finalizar, se citarán las ecuaciones químicas para las reacciones de síntesis de varios compuestos.
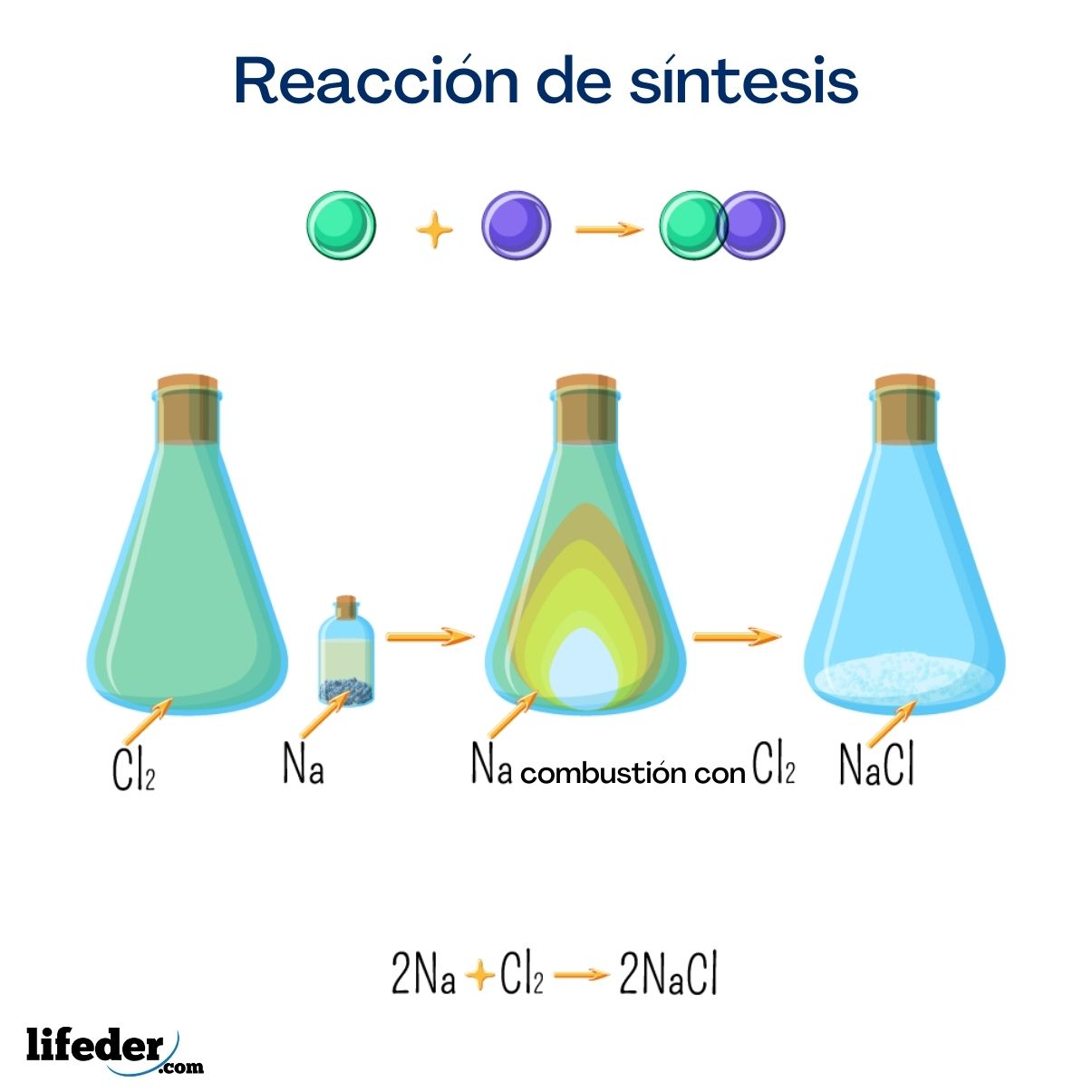
Esta sal es una de las más conocidas por todos por su gran uso doméstico. Se obtiene a partir de sodio y cloro, y a pesar de que puede ser obtenida por la reacción siguiente es muy fácil encontrarla de forma natural.
2 Na + Cl 2 → 2 NaCl
Esta es una de las reacciones más importantes para que exista la vida como la conocemos. Las plantas utilizan el dióxido de carbono y el agua del ambiente con luz solar para producir glucosa y oxígeno.
La reacción de forma muy general se puede apreciar a continuación, pero es importante entender que detrás de ella hay varias reacciones y mecanismos para que esto sea posible.
6CO2+6H2O→C6H12O6 + O2
Esta reacción de síntesis ocurre en los organismos vivos y se da al polimerizar glucosa con fructosa. Debido a su estructura, estas dos moléculas interactúan y el resultado final es sacarosa y agua, como se puede ver en la siguiente ecuación:
C6H12O6 + C6H12O6 → C12H22O11 +H2O
3 H2(g) + N2(g) → 2 NH3(g)
Los reactivos H2 y N2 son gaseosos. La presión debe ser alta para que sus moléculas reaccionen y originen el amoníaco, NH3. Se trata de una de las reacciones de síntesis más importantes de la química industrial.
2 H2(g) + O2(g) → 2 H2O(g)
El H2 y O2 reaccionan exotérmicamente para producir vapor de agua. La cantidad de energía liberada es tal, que el hidrógeno es uno de los combustibles más prometedores en aplicaciones aeroespaciales.
C2H4(g) + H2O(l) → CH3CH2OH(l)
El etanol se le conoce como alcohol, siendo en realidad apenas uno de los muchos alcoholes que existen. Su reacción de síntesis consiste en la hidratación del etileno, C2H4 o H2C=CH2, donde una molécula de agua se adiciona a su doble enlace.
El ácido sulfúrico posee varias rutas sintéticas eficientes. Sin embargo, la más simple consta de varios pasos:
S(s) + O2(g) → SO2(g)
2 SO2(g) + O2(g) ⇌ 2 SO3(g)
SO3(g) + H2O(l) → H2SO4(g)
H2SO4(g) → H2SO4(l)
El azufre se quema con exceso de oxígeno para transformarse primero en SO2, y luego en SO3. Seguidamente, el SO3 se hidrata para producir vapores de H2SO4, los cuales condensan finalmente en H2SO4 líquido. Esta síntesis es tan importante, que por sí sola indica cuán fuerte es la producción de toda una nación.
CO(g) + 2 H2(g) → CH3OH(l)
Los gases CO y H2 reaccionan y condensan sobre catalizadores metálicos para dar lugar al metanol, el alcohol más simple de todos.
Se puede producir a partir de una reacción muy sencilla que consiste en magnesio y ácido sulfúrico. Es muy difícil encontrarlo en la naturaleza sin agua.
Mg +H2SO4→H2 + MgSO4
Sucede naturalmente en varios procesos, al encontrarse la molécula de oxígeno diatómico con carbono se produce el dióxido de carbono.
Está presente en procesos naturales como la respiración, como reactivo en la fotosíntesis y se produce con facilidad en reacciones de combustión.
C +O2→CO2
El ácido clorhídrico es muy utilizado como un ácido barato y como un agente reactivo para síntesis de otros compuestos.
Cl2+H2→2HCl
Es ampliamente conocido como un agente muy abundante en la naturaleza, principalmente en las rocas, minerales y conchas en el mar. Su reacción se basa en la interacción del óxido de calcio con dióxido de carbono.
CaO +CO2 → CaCO3
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. (10th edition.). Wiley Plus.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Morrison y Boyd. (1987). Química orgánica. (Quinta edición). Addison-Wesley Iberoamericana.
- Metler Toledo. (s.f.). Synthesis Reactions. Recuperado de: mt.com
- Helmenstine, Anne Marie, Ph.D. (27 de agosto de 2020). Synthesis Reaction Description Plus Examples. Retrieved from thoughtco.com
- Wikipedia. (2020). Chemical synthesis. Recuperado de: en.wikipedia.org
- Danielle Reid. (2020). Synthesis Reaction: Definition, Formula & Examples. Study. Recuperado de: study.com
