Acetato de amonio: estructura, propiedades, usos y riesgos
El acetato de amonio es una sal inorgánica cuya fórmula química es NH4CH3COOH. Deriva de la mezcla del ácido acético, presente en el vinagre comercial a una concentración al 5%, y del amoníaco. Ambas sustancias de partida tienen olores característicos, por lo que es posible hacerse una idea de por qué esta sal huele a vinagre-amoníaco.
No obstante, el aspecto más resaltante de esta sal no es su olor, sino su bajo punto de fusión. Es tan bajo, que en cualquier laboratorio podría obtenerse en su versión líquida, donde los iones fluyen libremente para transportar cargas eléctricas.

Por otro lado, el acetato de amonio es delicuescente; es decir, absorbe agua o humedad del ambiente hasta disolverse por completo. Es por eso que, si bien en estado anhidro sus cristales son blancos, se tornan rápidamente brillantes (como los que están en el vaso de precipitados de la imagen superior).
Al ser una fuente sólida de amoníaco, debe manipularse de tal manera que se disminuya al mínimo la inhalación de sus vapores. Pero, a pesar de esta característica negativa, el NH4CH3COOH es útil para la preparación de soluciones buffer que conserven los alimentos, a la vez que es un componente de ciertos solventes extractores de proteínas.
Índice del artículo
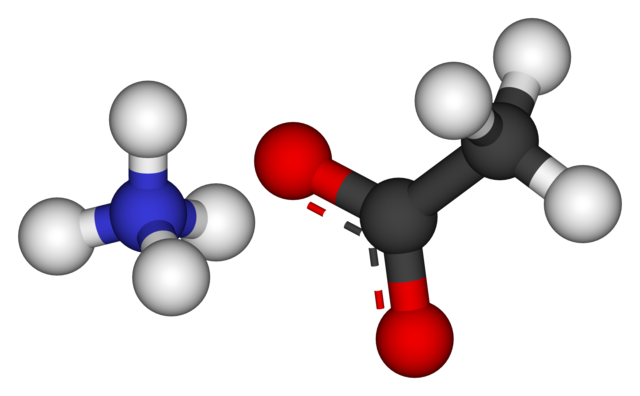
En la imagen superior se muestran los iones que componen el acetato de amonio en un modelo de esferas y barras. A la izquierda está el catión de geometría tetraédrica, NH4+, mientras que a su derecha el anión molecular con dos electrones deslocalizados entre dos átomos de oxígeno, CH3COO– (la línea punteada entre las esferas rojas).
Así ambos iones, NH4+ y CH3COO–, se mantienen unidos por su atracción electrostática que, junto a las repulsiones entre las cargas iguales, terminan por definir un cristal. Este cristal de acetato de amonio tiene una estructura ortorrómbica, la cual podría observarse en muestras microscópicas o incluso de tamaños visibles.
No solo es importante el enlace iónico para esta sal, sino que también lo son los puentes de hidrógeno. El NH4+ puede donar hasta cuatro de estos puentes; es decir, en cada uno de los vértices de su tetraedro se sitúa un átomo de oxígeno proveniente de un CH3COO– vecino (H3N+-H— OCOCH3).
En teoría, las fuerzas dentro de sus cristales deberían ser entonces muy fuertes; pero experimentalmente ocurre lo contrario, ya que funde apenas a 114°C. Por lo tanto, los puentes de hidrógeno no compensan la debilidad de su enlace iónico, ni la baja energía reticular del cristal ortorrómbico de NH4CH3COO.
Se dijo al principio que el acetato de amonio se prepara mezclando ácido acético y amoníaco. Por lo tanto, la sal también puede expresarse como: NH3·CH3COOH. Así, dependiendo de la composición, pueden obtenerse otras estructuras: NH3·2CH3COOH, o NH3·5CH3COOH, por ejemplo.
Asimismo, se mencionó que absorbe bastante humedad. Al hacerlo, incorpora moléculas de agua a sus cristales, las cuales se hidrolizan dando NH3 o CH3COOH; y es por eso que la sal emite olor a amoníaco o vinagre.
Cristales blancos delicuescentes con un olor a vinagre y amoníaco.
77,083 g/mol.
1,073 g/mL a 25ºC.
114ºC. Este valor es considerablemente inferior comparado al de otras sales o compuestos iónicos. Además, carece de punto de ebullición debido a la formación de amoníaco, implicando la descomposición de la sal.
143 g/100 mL a 20ºC. Nótese su extraordinaria solubilidad en agua, lo cual demuestra la afinidad que sienten las moléculas de agua por los iones NH4+ y CH3COO–, hidratándolos en esferas acuosas.
Su solubilidad no es tal en solventes menos polares. Por ejemplo, en 100 mL de metanol a 15ºC se disuelven 7,89 g de NH4CH3COO.
Es delicuescente, por lo que debe evitar almacenarse en espacios húmedos. Asimismo, mientras absorbe agua libera amoníaco, y por lo tanto, se descompone.
9,9.
Esta constante corresponde a la acidez del ion amonio:
NH4+ + B => NH3 + HB
Donde HB es un ácido débil. Si la base B se trata del agua, se tendrá su reacción de hidrólisis:
NH4+ + H2O => NH3 + H3O+
En la que la especie H3O+ define el pH de la solución.
Por otro lado, también el acetato contribuye al pH:
CH3COO– + H2O => CH3COOH + OH–
Así, ambas especies H3O+ y OH– se neutralizan dando un pH 7, neutro. Sin embargo, de acuerdo a Pubchem, las soluciones altamente concentradas de acetato de amonio tienen un pH ácido; lo que significa que predomina la hidrólisis del NH4+ sobre la del CH3COO–.
ΔfH298 = -615 kJ/mol.
Las soluciones acuosas de acetato de sodio permiten que se solubilice los sulfatos de plomo, hierro y cinc, para posteriormente determinarse su concentración mediante espectroscopia de absorción atómica.
Como se funde a una baja temperatura respecto a otras sales, su líquido puede utilizarse para conducir la corriente eléctrica que encienda el circuito de una bombilla.
Puede regular los cambios de pH en intervalos ácidos o básicos, lo cual se aprovecha para mantener un pH constante en, por ejemplo, las carnes, chocolates, quesos, vegetales u otros productos alimenticios.
Es una sal biodegradable y relativamente barata, usándose para descongelar caminos helados. Asimismo, por ser una fuente de nitrógeno soluble en agua, se destina a usos agrícolas para la determinación de los niveles de potasio.
Se utiliza esta sal para precipitar proteínas para realizar análisis cromatográficos.
El acetato de amonio funciona como agente diurético en veterinaria, y además es una sal necesaria para la síntesis de insulina y penicilina.
A continuación y para finalizar se enumeran algunos riesgos o consecuencias negativas que ocasiona el acetato de amonio:
– Puede producir irritaciones leves en la piel, pero sin absorberse en ella.
– Al ser ingerida causa malestar estomacal, diarrea, diuresis, ansiedad, mayor necesidad de orinar, temblores y otros síntomas relacionados con el envenenamiento por amoníaco, así como dañar el hígado.
– Su inhalación irrita la nariz, garganta y pulmones.
De resto, se desconoce si puede generar cáncer, y se descarta todo posible riesgo de incendio por parte de esta sal (al menos en condiciones normales de almacenaje).
- Inger Nahringbauer. (1967). Hydrogen Bond Studies. XIV. The Crystal Structure of Ammonium Acetate. Institute of Chemistry, University of Uppsala, Uppsala, Sweden. Acta Cryst. 23, 956.
- National Center for Biotechnology Information. (2019). Ammonium acetate. PubChem Database. CID=517165. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Sullivan Randy. (2012). Conductivity of Ammonium Acetate. Recuperado de: chemdemos.uoregon.edu
- Viachem, Ltd. (s.f.). Ammonium acetate. Recuperado de: viacheminc.com
- Wikipedia. (2019). Ammonium acetate. Recuperado de: en.wikipedia.org
- New Jersey Department of Health. (2012). Acetato de amonio: hoja informativa sobre sustancias peligrosas. [PDF]. Recuperado de: nj.gov
- Xueyanghu. (s.f.). Uses And Risks Of Ammonium Acetate. Recuperado de: xueyanghu.wordpress.com
