Piruvato quinasa: estructura, función, regulación, inhibición
¿Qué es la piruvato quinasa?
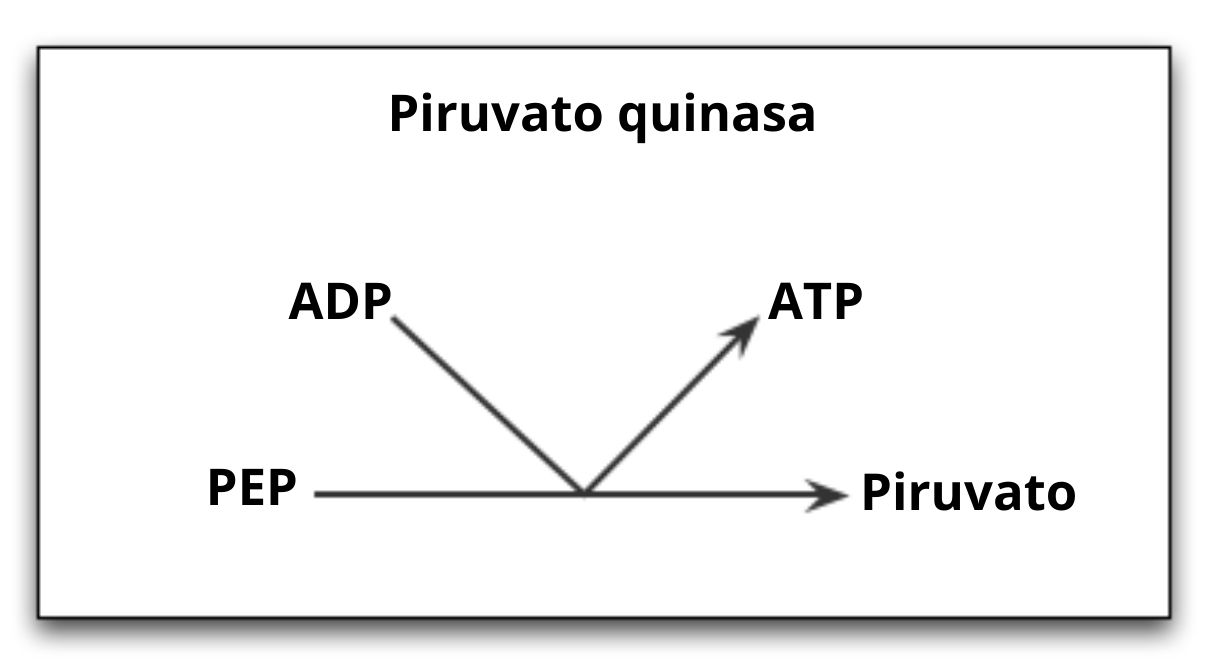
La piruvato quinasa (PYK) es la enzima que cataliza el último paso de la ruta glucolítica, que implica la transferencia irreversible del grupo fosfato de una molécula de fosfoenolpiruvato (PEP) hacia una molécula de ADP, lo que resulta en la síntesis de una molécula de ATP y otra de ácido pirúvico o piruvato.
El piruvato así producido posteriormente participa en diversas rutas catabólicas y anabólicas (biosintéticas): puede ser descarboxilado para producir acetil-CoA, carboxilado para producir oxalacetato, transaminado para producir alanina, oxidado para producir ácido láctico o puede ser dirigido hacia la gluconeogénesis para la síntesis de glucosa.
Puesto que participa en la glucólisis, esta enzima es de suma importancia para el metabolismo de carbohidratos de muchos organismos, unicelulares y multicelulares, que emplean esta como la principal ruta catabólica para la obtención de energía.
Un ejemplo de células estrictamente dependientes de la glucólisis para la obtención de energía es el de los eritrocitos de los mamíferos, para los cuales una deficiencia en cualquiera de las enzimas que participan en esta ruta puede tener efectos considerablemente negativos.
Estructura de la piruvato quinasa
En los mamíferos se han descrito cuatro isoformas de la enzima piruvato quinasa:
– PKM1, típica en los músculos
– PKM2, únicamente en los fetos (ambas productos del procesamiento alternativo del mismo ARN mensajero)
– PKL, presente en el hígado y
– PKR, presente en los eritrocitos (ambas codificadas por el mismo gen, PKLR, pero transcritas por promotores diferentes).
Empero, los análisis realizados a la estructura de las diferentes enzimas piruvato quinasa en la naturaleza (incluyendo estas 4 de los mamíferos) demuestran una gran similitud en la estructura general, así como respecto a la arquitectura del sitio activo y los mecanismos de regulación.
En líneas generales, se trata de una enzima de 200 kDa de peso molecular, caracterizada por una estructura tetramérica compuesta por 4 unidades proteicas idénticas, de más o menos 50 o 60 kDa, y cada una con 4 dominios, a saber:
– Un dominio helicoidal pequeño en el extremo N-terminal (ausente en las enzimas bacterianas)
– Un dominio “A”, identificado por una topología de 8 láminas β plegadas y 8 hélices α
– Un dominio “B”, insertado entre la lámina beta plegada número 3 y la hélice alfa número 3 del dominio “A”
– Un dominio “C”, que posee una topología α+β
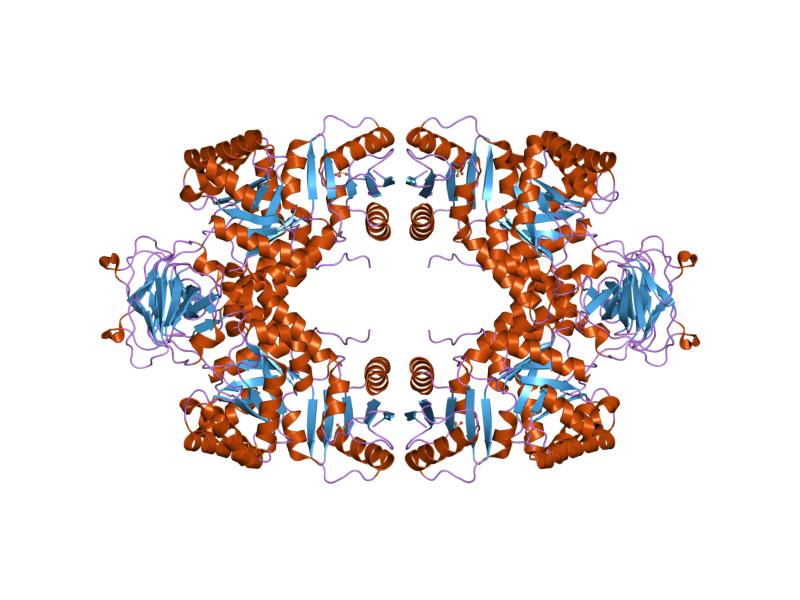
Se han detectado tres sitios en los tetrámeros de la piruvato quinasa de diferentes organismos: el sitio activo, el sitio efector y el sitio de unión a aminoácidos. El sitio activo de estas enzimas se encuentra entre los dominios A y B, en las cercanías del “sitio efector”, que pertenece al dominio C.
En el tetrámero, los dominios C forman una interfase “pequeña”, mientras que los dominios A forman una interfase de mayor tamaño.
Función de la piruvato quinasa
Como ya se comentó, la piruvato quinasa cataliza el último paso de la ruta glucolítica, es decir, la transferencia de un grupo fosfato desde el fosfoenolpiruvato (PEP) hacia una molécula de ADP para producir un ATP y una molécula de piruvato o ácido pirúvico.
Los productos de la reacción catalizada por esta enzima son de suma importancia para distintos contextos metabólicos. El piruvato puede ser empleado de distintas formas:
- En condiciones aeróbicas, es decir, en presencia de oxígeno, este puede ser empleado como sustrato de una enzima conocida como el complejo piruvato deshidrogenasa, para ser descarboxilado y convertido en acetil-CoA, molécula que puede ingresar al ciclo de Krebs en las mitocondrias o participar en otras rutas anabólicas como la biosíntesis de ácidos grasos, por ejemplo.
- En ausencia de oxígeno o anaerobiosis, el piruvato puede ser empleado por la enzima lactato deshidrogenasa para producir ácido láctico (oxidación) a través de un proceso conocido como “fermentación láctica”.
- Además, el piruvato puede ser convertido en glucosa por medio de la gluconeogénesis, en alanina por la alanina transaminasa, en oxalacetato por la piruvato carboxilasa, etc.
Es importante recordar que en la reacción catalizada por esta enzima también ocurre la síntesis neta de ATP que es contabilizada para la glucólisis, produciéndose por cada molécula de glucosa 2 moléculas de piruvato y 2 de ATP.
Así, desde esta perspectiva, la enzima piruvato quinasa tiene un papel fundamental en muchos aspectos del metabolismo celular, tanto así, que es utilizada como blanco terapéutico para muchos patógenos del ser humano, entre los que destacan diversos protozoarios.
Regulación
La piruvato quinasa es una enzima sumamente importante desde el punto de vista del metabolismo celular, pues es la que forma el último compuesto resultante de la ruta del catabolismo de la glucosa: el piruvato.
Además de ser una de las tres enzimas más reguladas de toda la ruta glucolítica (siendo las otras dos la hexoquinasa (HK) y la fosfofructoquinasa (PFK)), la piruvato quinasa es una enzima muy importante para el control del flujo metabólico y la producción de ATP por medio de la glucólisis.
Es activada por el fosfoenolpiruvato, uno de sus sustratos (regulación homotrópica), así como por otros azúcares mono- y difosforilados, aunque su regulación depende del tipo de isoenzima que se considere.
Algunos textos científicos sugieren que la regulación de esta enzima depende también de su arquitectura “multidominio”, pues su activación parece depender de algunas rotaciones en los dominios de las subunidades y de alteraciones en la geometría del sitio activo.
Para muchos organismos, la activación alostérica de la piruvato quinasa depende de la fructosa 1,6-bifosfato (F16BP), pero esto no es cierto para las enzimas vegetales. Otras enzimas son activadas también por el AMP cíclico y la glucosa 6-fosfato.
Además, se ha demostrado que la actividad de la mayor parte de las piruvato quinasas estudiadas depende enormemente de la presencia de iones monovalentes como el potasio (K+) y de iones divalentes como el magnesio (Mg+2) y el manganeso (Mn+2).
Inhibición
La piruvato quinasa es inhibida principalmente por efectores alostéricos fisiológicos, por lo que estos procesos varían considerablemente entre especies diferentes e incluso entre tipos de células y tejidos del mismo organismo.
En muchos mamíferos, el glucagón, la epinefrina y el AMPc tienen efectos inhibitorios sobre la actividad de la piruvato quinasa, efectos que pueden ser contrarrestados por la insulina.
Además, se ha comprobado que algunos aminoácidos como, por ejemplo, la fenilalanina, pueden tener acciones como inhibidores competitivos para esta enzima en el cerebro.
