GMP cíclico: formación y degradación, estructura, funciones
El GMP cíclico, también conocido como guanosín monofosfato cíclico, monofosfato cíclico de guanosina o guanosina 3’,5’-monofosfato, es un nucleótido cíclico implicado en numerosos procesos celulares, especialmente en aquellos relacionados con la señalización y la comunicación intracelular.
Fue descrito por primera vez hace más de 40 años poco después del descubrimiento de su análogo, el AMP cíclico, que se diferencia de este en cuanto a la base nitrogenada, pues no se trata de un nucleótido de guanina sino de adenina.
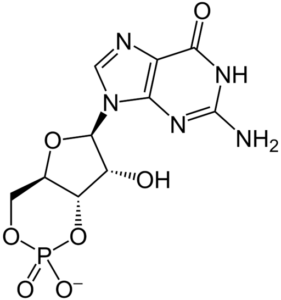
Al igual que otros nucleótidos cíclicos como el ya mencionado AMP cíclico o como el CTP cíclico (citidin monofosfato cíclico), la estructura del GMP cíclico es determinante para sus propiedades químicas y su actividad biológica, además de que lo hace más estable que su contraparte.
Este nucleótido es producido por una enzima conocida como guanilil ciclasa y es capaz de disparar cascadas de señalización de proteínas quinasas GMP cíclico-dependientes, de una forma similar al AMP cíclico.
Ha sido descrito no solo en mamíferos, que son animales de gran complejidad, sino también en los más simples procariotas, incluidos en los reinos de las eubacterias y las arqueas. Su presencia en plantas aún es motivo de discusión, pero la evidencia sugiere que está ausente en estos organismos.
Índice del artículo
La concentración intracelular de los nucleótidos cíclicos de guanina, así como la de los de adenina, es extremadamente baja, sobre todo si se compara con la de sus análogos no cíclicos que son mono-, di- o trifosfatados.
No obstante, los niveles de este nucleótido pueden alterarse selectivamente en presencia de determinados estímulos hormonales y de otros factores que se comportan como mensajeros primarios.
El metabolismo del GMP cíclico es parcialmente independiente del metabolismo del AMP cíclico y otros nucleótidos análogos. Este es producido a partir de GTP por un sistema enzimático conocido como guanilil ciclasa o guanilato ciclasa, que es una enzima parcialmente soluble en la mayor parte de los tejidos.
Las enzimas guanilato ciclasas se encargan de la “ciclación” del grupo fosfato en posición 5’ del residuo azucarado (ribosa), ocasionando la unión de un mismo fosfato a dos grupos OH distintos en la misma molécula.
Esta enzima es muy abundante en el intestino delgado y los pulmones de los mamíferos y la fuente más activa se encuentra en el esperma de una especie de erizo de mar. En todos los organismos que se ha estudiado depende de iones divalentes de manganeso, lo que la diferencia de las adenilato ciclasas, que dependen de magnesio o zinc.
La degradación del GMP cíclico es mediada por fosfodiesterasas de nucleótidos cíclicos que no parecen ser específicas, puesto que se ha demostrado que las mismas enzimas son capaces de emplear como sustratos hidrolizables tanto al AMP cíclico como al GMP cíclico.
Ambos procesos, el de formación y el de degradación, están cuidadosamente controlados intracelularmente.
La estructura del GMP cíclico no dista considerablemente de la de otros nucleótidos cíclicos. Como su nombre lo indica (guanosina 3’,5’-monofosfato) posee un grupo fosfato unido al oxígeno en el carbono de la posición 5’ de un azúcar ribosa.
Dicha azúcar ribosa está unida al mismo tiempo a la base nitrogenada de anillo heterocíclico guanina por medio de un enlace glucosídico con el carbono en la posición 1’ de la ribosa.
El grupo fosfato que está unido al átomo de oxígeno en la posición 5’ de la ribosa está fusionado en trans por medio de un enlace fosfodiéster, que se da entre el mismo grupo fosfato y el oxígeno del carbono en posición 3’ de la ribosa, formando así un fosfato 3’-5’- “trans-fusionado” (del inglés 3’-5’-trans-fused phosphate).
La fusión del grupo fosfato o su “ciclación” ocasiona un incremento en la rigidez de la molécula, puesto que restringe la libre rotación de los enlaces en el anillo furano de la ribosa.
Como también es cierto para el AMP cíclico, el enlace glucosídico entre el anillo de guanina y la ribosa y su libertad de rotación son parámetros estructurales importantes para el reconocimiento específico del GMP cíclico.
A diferencia de las múltiples y muy variadas funciones que tienen otros nucleótidos cíclicos análogos como el AMP cíclico, la función del GMP cíclico es un poco más restringida:
1-Participa en los procesos de señalización en respuesta a la estimulación lumínica de los pigmentos visuales. Su concentración se modifica debido a la activación de una proteína G que percibe el estímulo luminoso e interactúa con una fosfodiesterasa GMP cíclico dependiente.
Los cambios en los niveles de este nucleótido alteran la permeabilidad de la membrana de las células oculares en forma de bastón a los iones de sodio, lo que ocasiona otros cambios que terminan con la transmisión del estímulo hacia el nervio óptico.
2-Tiene funciones en el ciclo de contracción y relajación muscular del músculo liso en respuesta al óxido nítrico y a otros compuestos químicos de diversa naturaleza.
3-Un incremento en su concentración debido a la respuesta frente a péptidos natriuréticos está relacionado con la regulación del movimiento de iones de sodio y agua a través de las membranas celulares.
4-En algunos organismos, el GMP cíclico puede competir con el AMP cíclico por la fosfodiesterasa de nucleótidos cíclicos, y la adición de GMP cíclico puede contribuir al incremento en la concentración de AMP cíclico por disminución de su degradación.
5-Bacterias como E. coli incrementan sus niveles de GMP cíclico cuando son expuestas a quimio-atrayentes, lo que indica que este nucleótido está implicado en los procesos de señalización en respuesta a estos estímulos químicos.
6-Se ha determinado que el GMP cíclico también tiene importantes implicaciones en la vasodilatación y los procesos de erección en los mamíferos.
7-Muchos canales iónicos de compuerta (de calcio y de sodio) están regulados por ligandos intracelulares que emplean específicamente el GMP cíclico.
- Botsford, J. L. (1981). Cyclic Nucleotides in Prokaryotes. Microbiological Reviews, 45(4), 620–642.
- Garrett, R., & Grisham, C. (2010). Biochemistry (4th ed.). Boston, USA: Brooks/Cole. CENGAGE Learning.
- Hardman, J., Robison, A., & Sutherland, E. (1971). Cyclic nucleotides. Annual Reviews in Physiology, 33, 311–336.
- Nelson, D. L., & Cox, M. M. (2009). Lehninger Principios de Bioquímica. Ediciones Omega (5th ed.).
- Newton, R. P., & Smith, C. J. (2004). Cyclic nucleotides. Phytochemistry, 65, 2423–2437.
