Cápsula de Bowman: estructura, histología, funciones
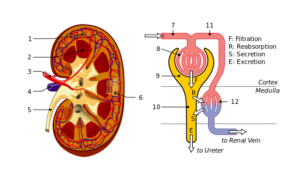
La cápsula de Bowman representa el segmento inicial del componente tubular de la nefrona, unidad anátomo-funcional del riñón en la cual se llevan a cabo los procesos destinados a la producción de orina y con los cuales el riñón contribuye a la conservación de la homeostasis del organismo.
Fue denominada así en honor del médico oftalmólogo y anatomista inglés sir William Bowman, quien descubriera su existencia y publicara su descripción histológica por primera vez en 1842.

Existe en la literatura una cierta confusión en relación con la nomenclatura de los segmentos iniciales de la nefrona, entre los cuales se incluye la cápsula de Bowman. A veces es descrita como parte distinta al glomérulo y constituyendo con él el corpúsculo renal, mientras que para otros tiene función como integrante del glomérulo.
Independientemente de que en las descripciones anatómicas la cápsula forme parte o forme parte del glomérulo, el hecho es que ambos elementos están tan íntimamente asociados en su estructura y función, que el término glomérulo despierta en quien lo piensa la idea de una esferita con sus vasos.
De no ser así, la cápsula sería simplemente un receptáculo en el cual se vierte el líquido filtrado en el glomérulo, pero no tendría parte en el proceso mismo de filtración glomerular. Cosa que no es así, puesto que ella, como se verá, forma parte de ese proceso al cual contribuye de manera especial.
Índice del artículo
- 1 Estructura e histología
- 2 Funciones
- 3 Determinantes de la magnitud de la filtración glomerular
- 4 Índice de filtración (IF) de las sustancias presentes en el plasma
- 5 Referencias
La cápsula de Bowman es como una esfera diminuta cuya pared se invagina en el sector vascular. En dicha invaginación la cápsula es penetrada por el ovillo de capilares, que se origina en la arteriola aferente y que aporta sangre al glomérulo, de donde también sale la arteriola eferente que saca la sangre del glomérulo.
El extremo opuesto de la cápsula, llamado polo urinario, se presenta como si la pared de la esfera tuviera un agujero al cual se conecta el extremo del primer segmento que inicia la función tubular propiamente dicha, es decir, el túbulo contorneado proximal.
Esta pared externa de la cápsula es un epitelio plano y se denomina epitelio parietal de la cápsula de Bowman. Cambia de estructura al hacer la transición hacia epitelio del túbulo proximal en el polo urinario y hacia epitelio visceral en el polo vascular.
El epitelio invaginado se llama visceral porque envuelve a los capilares glomerulares como si estos fueran una víscera. Está formado por unas células llamadas podocitos que abrazan, recubriéndolos, a los capilares y que tienen características muy particulares.
Los podocitos se organizan en una sola capa, emitiendo prolongaciones que se interdigitan con las prolongaciones de podocitos vecinos, dejando unos espacios entre ellos llamados poros en hendidura o rendijas de filtración y que son soluciones de continuidad para el paso del filtrado.
Los podocitos y las células endoteliales a las que recubren sintetizan una membrana basal sobre la cual se apoyan y que también posee soluciones de continuidad para el paso de agua y sustancias. Las células endoteliales son fenestradas y permiten también la filtración.
Así que estos tres elementos: endotelio capilar, membrana basal y epitelio visceral de la cápsula de Bowman, constituyen en conjunto la membrana o barrera de filtración.
La cápsula está asociada al proceso de filtración glomerular. Por un lado, porque de ella forma parte la cubierta epitelial de podocitos que envuelve a los capilares glomerulares. Además contribuye la síntesis de la membrana basal sobre la cual se apoya este epitelio y el endotelio capilar glomerular.
Estas tres estructuras: endotelio capilar, membrana basal y epitelio visceral de la cápsula de Bowman, constituyen la llamada membrana o barrera de filtración, y cada una de ellas tiene sus características propias de permeabilidad que contribuyen a la selectividad global de esa barrera.
Además, el volumen de líquido que penetra al espacio de Bowman, junto con el grado de rigidez que opone la pared externa capsular, determinan la génesis de una presión intracapsular que contribuye a modular la presión efectiva de filtración y a impulsar el líquido a lo largo del túbulo asociado.
Una variable que recoge la magnitud del proceso de filtración glomerular es el llamado volumen de filtración glomerular (VFG), que es el volumen de líquido que se filtra en la totalidad de los glomérulos en la unidad de tiempo. Su valor normal promedio es de unos 125 ml/min o 180 L/día.
La magnitud de esta variable está determinada desde el punto de vista físico por dos factores, a saber, el llamado coeficiente de filtración o ultrafiltración (Kf) y la presión efectiva de filtración (Peff). Es decir: VFG = Kf x Peff (ecuación 1)
El coeficiente de filtración (Kf) es el producto de la conductividad hidráulica (LP), que mide la permeabilidad al agua de una membrana en ml/min por unidad de área y unidad de presión impulsora, por el área de superficie (A) de la membrana filtrante, es decir Kf = LP x A (ecuación 2).
La magnitud del coeficiente de filtración indica el volumen de líquido que se filtra por unidad de tiempo y por unidad de presión efectiva impulsora. Aunque es muy difícil de medir directamente, se puede obtener a partir de la ecuación 1, dividiendo VFG/Peff.
El Kf en los capilares glomerulares es de 12,5 ml/min/mmHg por c/100g de tejido, valor unas 400 veces más alto que el Kf de otros sistemas capilares del cuerpo, en donde se pueden filtrar unos 0,01 ml/min/mm Hg por 100 g de tejido. Comparación que muestra la eficiencia filtrante glomerular.
La presión efectiva de filtración representa el resultado de la suma algebraica de las distintas fuerzas de presión que favorecen o se oponen a la filtración. Existe un gradiente de presión hidrostática (ΔP) y otro de presión osmótica (oncótica, ΔП) determinado por la presencia de proteínas en el plasma.
El gradiente de presión hidrostática es la diferencia de presión entre el interior del capilar glomerular (PCG = 50 mm Hg) y el espacio de la cápsula de Bowman (PCB = 12 mm Hg). Como se ve, este gradiente está dirigido del capilar a la cápsula y promueve el desplazamiento de líquido en ese sentido.
El gradiente de presión osmótica mueve líquido de menor a mayor presión osmótica. Solo las partículas que no filtren ejercen este efecto. Las proteínas no filtran. Su ПCB es 0 y en el capilar glomerular ПCG es de 20 mm Hg. Este gradiente mueve líquido de la cápsula al capilar.
La presión efectiva se puede calcular aplicando Peff = ΔP–ΔП; = (PCG-PCB ) – (ПCG-ПCB); =(50-12)-(20-0); =38-20 = 18 mm Hg. Existe, pues, una presión efectiva o neta de filtración de unos 18 mm Hg que determina un VFG de unos 125 ml/min.
Es un indicador de la facilidad (o dificultad) con que una sustancia presente en el plasma puede atravesar la barrera de filtración. El índice se obtiene dividiendo la concentración de la sustancia en el filtrado (FX) entre su concentración en el plasma (PX), es decir: IFX= FX/ PX.
El rango de valores del IF está entre un máximo de 1 para aquellas sustancias que filtren libremente, y 0 para aquellas que no filtran nada. Los valores intermedios son para partículas con dificultades intermedias. Mientras más cerca de 1 el valor, mejor la filtración. Más cercano a 0, más difícil filtra.
Uno de los factores que determina el IF es el tamaño de la partícula. Las que tienen diámetros menores de 4 nm filtran libremente (IF=1). A medida que el tamaño crece y se acerca al de la albúmina el IF se va reduciendo. Partículas del tamaño de la albúmina, o mayores, tienen IFs de 0.
Otro factor que contribuye a determinar el IF son las cargas eléctricas negativas en la superficie molecular. Las proteínas tienen mucha carga negativa, lo que se añade a su tamaño para dificultar su filtrabilidad. La razón es que los poros tienen cargas negativas que repelen a las de las proteínas.
- Ganong WF: Renal Function and Micturition, in Review of Medical Physiology, 25th ed. New York, McGraw-Hill Education, 2016.
- Guyton AC, Hall JE: The Urinary System, in Textbook of Medical Physiology , 13th ed, AC Guyton, JE Hall (eds). Philadelphia, Elsevier Inc., 2016.
- Lang F, Kurtz A: Niere, in Physiologie des Menschen mit Pathophysiologie, 31 th ed, RF Schmidt et al (eds). Heidelberg, Springer Medizin Verlag, 2010.
- Silbernagl S: Die funktion der nieren, in Physiologie, 6th ed; R Klinke et al (eds). Stuttgart, Georg Thieme Verlag, 2010.
- Stahl RAK et al: Niere und ableitende Harnwege, in Klinische Pathophysiologie, 8th ed, W Siegenthaler (ed). Stuttgart, Georg Thieme Verlag, 2001.
