Biftalato de potasio: estructura, nomenclatura, usos, riesgos
El biftalato de potasio es un compuesto químico, sólido, de color blanco, soluble, que se encuentra comercialmente en estado de alta pureza. Es utilizado como patrón primario para estandarizar soluciones en las titulaciones ácido-base; también es usado como solución tampón para mantener estable el pH de las soluciones.
Es un compuesto estable, no higroscópico, lo que facilita la preparación de la disolución dado que no absorbe agua durante el proceso de pesada. Se puede preparar mediante la reacción entre el ácido ftálico y una solución de KOH, en la que un hidrógeno de la molécula de ácido ftálico es reemplazado por un átomo de potasio.
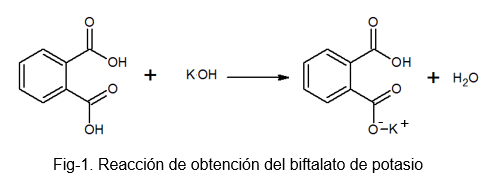
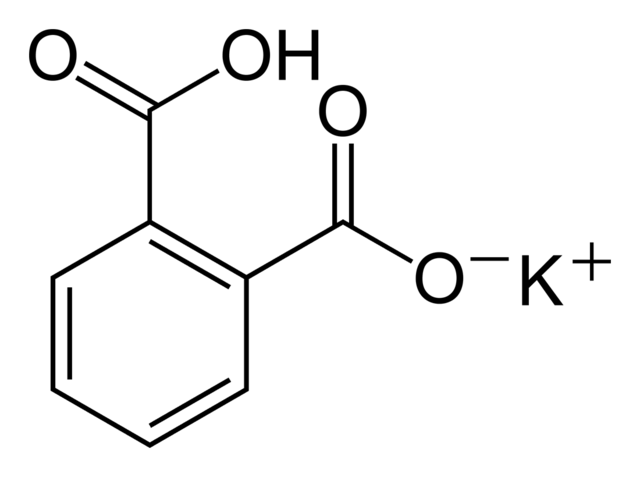
El biftalato de potasio recibe este nombre porque en su molécula hay un hidrógeno ligeramente ácido. Este hidrógeno es el que se encuentra en el grupo -OH que se encuentra justo al lado del grupo carbonílico, que hace parte del carboxilo que no reacciona. A este tipo de sales se les conoce con el nombre de sales ácidas, pues no son totalmente neutras.
Índice del artículo
- 1 Estructura química
- 2 Fórmula
- 3 Nomenclatura
- 4 Propiedades
- 5 Estudio derivatográfico del biftalato de potasio
- 6 Usos y aplicaciones
- 7 Riesgos
- 8 Referencias
C6H4COOHCOOK = C8H5 KO4
– Biftalato de potasio.
– Ftalato ácido de potasio.
– Hidrogenoftalato de potasio.
1,636 g/mL.
204.22 g/mol.
Agua y alcohol.
295 °C con descomposición.
Sólido cristalino a blanco.
1,64 gr/cm3.
Mediciones derivatográficas han demostrado que la descomposición del biftalato de potasio comienza entre 190 °C y 200 °C, y la preparación no higroscópica se puede preparar entre 100 °C y 150 °C.
La descomposición procede en tres pasos, cuya velocidad depende de la tasa en el aumento de la temperatura: el ftalato dipotásico se forma primero, se elimina el anhídrido ftálico y el agua.
Los cambios de entalpía también se pueden obtener a partir del derivatograma, esto produce información sobre el mecanismo adicional de descomposición térmica y cambios de estado de la muestra.
Este compuesto es usado en química analítica en la titulación o valoración ácido–base como patrón primario para la estandarización en la preparación de soluciones de diferentes compuestos.
Al preparar una solución de NaOH no se puede garantizar que la concentración con la que queda la solución es la correcta; esto se debe a que el NaOH es una sustancia sólida muy higroscópica (absorbe agua del aire), y al pesarla queda con algo de humedad, lo que hace que la cantidad de sustancia no sea la más óptima.
Una vez que se prepara la solución es necesario conocer exactamente con qué concentración ha quedado.
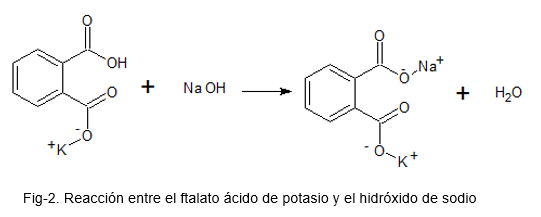
Para ello se prepara una solución con el ftalato ácido de potasio, que es un patrón primario (por su alta estabilidad); se añaden unas gotas de indicador acido-base de fenolftaleína y se procede a agregar la solución de NaOH como titulante hasta que un color rosa se mantenga presente en la solución de ftalato ácido de potasio.
Con los datos obtenidos se procede a realizar los cálculos pertinentes para encontrar la concentración real del NaOH.
En la siguiente imagen se ilustra la reacción química entre el ftalato ácido de potasio y el hidróxido de sodio.
Una solución amortiguadora o buffer es la que está formada tanto por el ácido como por la sal del ácido, esto hace que se mantenga en unas condiciones tales que el valor del pH no cambie cuando se agregan pequeñas cantidades de ácido o de base.
– Exposición al fuego. Al igual que con la mayoría de los sólidos orgánicos, es posible que se produzca incendio a temperaturas elevadas o por contacto con una fuente de encendido.
– El polvo fino dispersado en aire en concentraciones suficientes, y en la presencia de una fuente de ignición, es un potencial de peligrosa explosión de polvo.
– Es una sustancia estable a temperatura ambiente y en condiciones adecuadas de almacenamiento. Se debe evitar el excesivo calor y la humedad.
– Puede ser incompatible con oxidantes fuertes como el ácido nítrico.
– La descomposición puede formar óxidos de carbono que son tóxicos.
– Por ingestión accidental, puede causar vómito, diarrea e irritación en las membranas debido a su acidez.
– Por inhalación causa irritación en las vías respiratorias y tos.
– En la piel causa irritación.
– En los ojos causa irritación, enrojecimiento y dolor.
– Se considera que no es una sustancia cancerígena, teratogénica ni mutagénica.
– Lavar los ojos con abundante agua, quitar lentillas en caso de llevarlas y dejar que el agua corra por los ojos sin que sean tocados con las manos.
– Si hubo contacto con la piel, retirar vestuario y calzado, lavar con abundante agua y lavar muy bien las prendas antes de volver a usar.
– En caso de ingestión, evite provocar el vómito, dé a beber agua.
– En caso de inhalación, llevar a la persona a respirar aire fresco; en caso de respiración dificultosa, suministrar oxígeno.
– En todos los casos pedir asistencia médica urgente.
– En caso de fugas o derrame, recoger el producto en un recipiente limpio y tratar de que el polvo no se disperse.
– Manténgase fuera del lugar donde se almacenan bebidas, alimentos y piensos (alimento para mascotas).
– Usar máscaras anti polvo, guantes de neopreno o PVC. En la actualidad se usan los guantes de nitrilo.
– Llevar ropa adecuada que cubra la mayor parte del cuerpo, inclusive botas o zapato cubierto y gafas de seguridad.
– Se recomienda ventilación de escape local, con sistema de extractores de aire, teniendo en cuenta la dirección del viento predominante.
– El producto es miscible en agua, no se absorbe en el suelo, no es bioacumulable ni biodegradable, no se espera que afecte la vida acuática. Sin embargo, al momento de desecharlo se debe hacer con la ayuda de personal especializado: no desechar por desagües.
– Almacénese en área color naranja/verde, lugar fresco seco y ventilado, y separado de material incompatible.
- Merck,(s.f),merckmillipore.com
- Chang R.,(1992),Química, (cuarta edición),México, McGraw-Hill Interamericana de México S.A, de C.V
- Reactivos química meyer,(s.f), hoja de datos de seguridad, biftalato de potasio, Recuperado de, reactivosmeyer.com.mx
- Belcher,R.,Erdey,L.,Paulik,F.,Liptay.G.,(July 1960), Estudio derivatográfico del hidrogenoftalato de potasio, Sciencedirect, Volume 5, Issue 1, Pages 53-57, org/10.1016/0039-9140(60)80205-6
