Epóxido: nomenclatura, obtención, aplicaciones, ejemplos
Los epóxidos son hidrocarburos alifáticos o cíclicos que tienen en su estructura un átomo de oxígeno enlazado al mismo tiempo a dos átomos de carbono. Este enlace, tal como se observa en la imagen inferior, presenta una geometría triangular, bastante característica para todos los epóxidos.
Los epóxidos se originan a partir de alquenos que sufren la ruptura de un doble enlace para formar el grupo funcional epóxido. Cada uno de los dos átomos enlazados al oxígeno está asimismo enlazado a grupos laterales R1, R2, R3 y R4, todos partes de la misma molécula.

El grupo funcional epóxido se caracteriza por tener una gran tensión, lo que confiere una reactividad mayor que la de un éter no cíclico. Las reacciones de los epóxidos suelen estar acompañadas por la ruptura de su grupo funcional.
El epóxido más simple corresponde al epóxido de etano, llamado también óxido de etileno, etilen óxido u oxirano. De todos, este es el epóxido de mayor importancia comercial.
La mayor proporción de la producción de epóxidos está destinada a la elaboración de pinturas (recubrimientos de superficies). También se utilizan en la producción de surfactantes, adhesivos, plastificantes, etc.
Índice del artículo
Los compuestos con el grupo funcional epóxidos pueden denominarse de distintas formas, tales como: epoxi, epóxidos, u otros nombres sin ninguna connotación sistemática, como por ejemplo: oxirano.
Los epóxidos con las estructuras química más simples suelen nombrarse como óxidos. De esta manera, el epóxido de propeno (C3H6) se llama óxido de propeno (C3H6O).
Es común que se denomine al epóxido identificando los carbonos que están presentes en el grupo funcional epóxido. Por ejemplo: 2,3-epoxihexano, 1,2-epoxiciclohexano, y 1,2-epoxipropano. Es decir, el “triángulo” se halla en los carbonos 2 y 3 del hexano, y así sucesivamente con el ciclohexano y el propano.
El epóxido de etano u óxido de etileno se prepara por la oxidación catalítica del etileno en aire caliente u oxigeno, usándose como catalizador plata metálica:

Este método se realiza en dos etapas: a) Formación de la clorohidrina, y b) Tratamiento de la clorohidrina con una base para eliminar el ácido clorhídrico.

En la etapa b) se pierde una molécula de HCl, cuyo hidrógeno proviene del grupo OH.
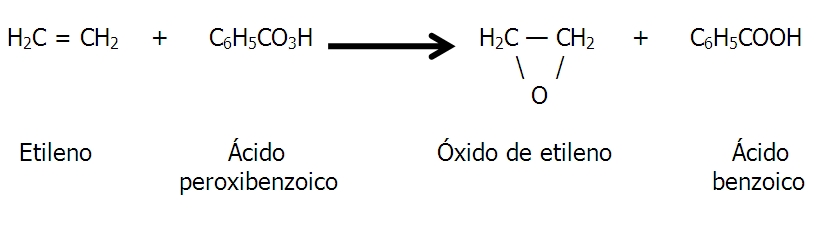
Los epóxidos también pueden formarse mediante la peroxidación de los alquenos, esto es, una oxidación provocada por un peroxiácido, como el ácido peroxibenzoico:
Los epóxidos son poco comunes en la naturaleza. Sin embargo, se ha observado la síntesis hepática de epóxidos, mediada por el citocromo P450. Las células producen los epóxidos como productos de oxidación de los alquenos y compuestos aromáticos.
También se han observado en la naturaleza compuestos como las epotilonas, producidas como un metabolito secundario de la bacteria Sorangium cellulosum.
El óxido de etileno se utiliza con frecuencia en la preparación de surfactantes o tensioactivos, productos de la reacción de un alcohol o fenol con el óxido de con etileno. Los surfactantes cumplen diferentes funciones, entre ellas: humectantes, detergentes, emulsionantes y solubilizantes.
Los humectantes aumentan la hidratación de superficies al facilitar el acceso del agua a ellas. Los detergentes eliminan la suciedad de la ropa. Los emulsionantes permiten y estabilizan las emulsiones. Y los solubilizantes permiten la disolución de compuestos pocos miscibles con el agua.
La reacción de los epóxidos, entre ellos el óxido de etileno, con las aminas es la base para la preparación de colas o gomas de pegar. Estos adhesivos se utilizan para producir la unión de superficies, así como en la estabilización del PVC.
El óxido de etileno reacciona con el etóxido de sodio para producir 2-etoxietanol, también conocido como Cellosolve. Este compuesto químico disuelve aceites, resinas, grasas, ceras, nitrocelulosa y lacas.
Las resinas epoxídicas o epoxi tienen entre sus propiedades, una vez que han sido reforzadas, una alta resistencia química, térmica y mecánica. Estas resistencias permiten su utilización para la elaboración de lacas y esmaltes, así como para el recubrimiento de metales y de pisos de laboratorios y fabricación de piezas eléctricas.
Algunas compañías utilizan estas resinas con rellenos de sílice en sustitución de la porcelana para fabricar aisladores de líneas eléctricas. Las resinas epoxi también se usan para fabricar láminas para circuitos impresos y placas reforzadas con fibras de vidrio.
Las resinas epoxi tienen por separado pocos usos, entre ellos incrementar la estabilidad del vinilo. Para aumentar su utilidad son entrecruzadas con varios compuestos en un proceso conocido como “curado”. Entre los agentes usados para este fin tenemos: aminas primarias, secundarias, terciarias, y poliamidas.
Los epóxidos obtenidos de aceites vegetales se usan para la síntesis de polioles, utilizados en la industria del poliuretano.
Las epotilonas son productos metabólicos de la bacteria Sorangium cellulosum, las cuales tienen la propiedad de estabilizar los microtúbulos, produciendo así un bloqueo del ciclo celular.
Se ha aprobado el uso de la ixabepilona, una epotilonas, para el tratamiento del cáncer de mama avanzado. Asimismo, se ha estudiado el uso de la epotilona D en el tratamiento del Alzheimer.
El óxido de etileno interviene en la síntesis de etilenglicol: compuesto usado como anticongelante en los sistemas de refrigeración de los automóviles. También se utiliza el óxido de etileno en la esterilización de materiales e instrumentos médicos.
La absorción a través de la piel, la inhalación o la ingesta de epóxidos están asociadas a la producción de efectos tóxicos, tanto en el hombre como en animales experimentales. Estos incluyen: irritación de los tejidos superficiales y sensibilización. También se producen alteraciones en el funcionamiento hepático, en las células sanguíneas y en la médula ósea.
Asimismo, se han relacionado a los epóxidos con carcinogenicidad y mutagenicidad. Los epóxidos, debido su alta reactividad electrofílica y a su carácter de compuestos alquilantes, han sido considerados como potenciales agentes carcinogénicos.
Para finalizar, se enlistarán algunos otros ejemplos de epóxidos:
-1,2-Epoxipropano
-2,3-Epoxihexano
-1,2-Epoxiciclohexano
-Óxido de estireno
-Óxido de isobutileno
-3,4-epoxi-1-buteno
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. (10th edition.). Wiley Plus.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Morrison y Boyd. (1987). Química orgánica. (Quinta edición). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Epoxide. Recuperado de: en.wikipedia.org
- Leroy G. Wade. (2020). Epoxide. Encyclopædia Britannica. Recuperado de: britannica.com
- Manson M. M. (1980). Epoxides: is there a human health problem? British journal of industrial medicine, 37(4), 317–336. doi.org/10.1136/oem.37.4.317
- Químicas. (s.f.). Ejemplos de Epóxidos. Recuperado de: quimicas.net
- W.G. Potter. (1963). The Chemistry and Uses of Epoxide Resins, Occupational Medicine, Volume 13, Issue 1, April 1963, Pages 42–47, doi.org/10.1093/occmed/13.1.42
- Molinero Muñoz, María y Fernández Arberas, Nerea. (2016). Epotilonas, una alternativa en el campo de los antitumorales. Universidad Complutense Madrid.
- Alejandro Aguirre F. & Lesly Espinoza B. (2018). Usos y aplicaciones de éteres epóxidos y sulfuros. Universidad Central del Ecuador. Recuperado de: academia.edu
