Oxidorreductasas: características, estructura, funciones, ejemplos
Las oxidorreductasas son unas proteínas con actividad enzimática que están encargadas de catalizar reacciones de óxido reducción, es decir, reacciones que implican la remoción de átomos de hidrógeno o de electrones en los sustratos sobre los que actúan.
Las reacciones catalizadas por estas enzimas, como su nombre lo indica, son reacciones de óxido-reducción, es decir, reacciones donde una molécula dona electrones o átomos de hidrógeno y otra los recibe, cambiando sus estados de oxidación respectivos.
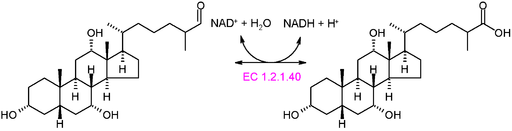
Ejemplo de enzimas oxidorreductasas muy comunes en la naturaleza es el de las deshidrogenasas y oxidasas. Podría mencionarse a la enzima de alcohol deshidrogenasa, que cataliza la deshidrogenación del etanol para producir acetaldehído de forma NAD+ dependiente o la reacción inversa, para producir etanol durante la fermentación alcohólica llevada a cabo por algunas levaduras comercialmente importantes.
Las enzimas de la cadena transportadora de electrones en las células aeróbicas son oxidorreductasas encargadas del bombeo de protones, por lo que generan el gradiente electroquímico a través de la membrana mitocondrial interna que permite impulsar la síntesis de ATP.
Índice del artículo
Las enzimas oxidorreductasas son enzimas que catalizan la oxidación de un compuesto y la concomitante reducción de otro.
Estas requieren, normalmente, de la presencia de distintos tipos de coenzimas para su funcionamiento. Las coenzimas cumplen la función de donar o aceptar los electrones y los átomos de hidrógeno que las oxidorreductasas añaden o quitan a sus sustratos.
Estas coenzimas pueden ser el par NAD+/NADH o el par FAD/FADH2. En muchos sistemas metabólicos aeróbicos, estos electrones y átomos de hidrógeno son eventualmente transferidos desde las coenzimas involucradas al oxígeno.
Son enzimas con una pronunciada “falta” de especificidad de sustrato, lo que les permite catalizar reacciones de entrecruzamiento en distintos tipos de polímeros, bien se trate de proteínas o de carbohidratos.
Muchas veces, la nomenclatura y clasificación de estas enzimas se basa tanto en el sustrato principal que emplean como en el tipo de coenzima que requieren para funcionar.
Según las recomendaciones del Comité de Nomenclatura de la Unión Internacional para Bioquímica y Biología Molecular (NC-IUBMB), estas enzimas pertenecen a la clase E.C. 1 e incluyen más o menos 23 tipos diferentes (E.C.1.1-E.C.1.23), que son:
– E.C. 1.1: las cuales actúan en los grupos CH-OH de los donadores.
– E.C. 1.2: las cuales actúan en el grupo aldehído o el grupo oxo de los donadores.
– E.C. 1.3: las cuales actúan en los grupos CH-CH de los donadores.
– E.C. 1.4: las cuales actúan en los grupos CH-NH2 de los donadores.
– E.C. 1.5: las cuales actúan en los grupos CH-NH de los donadores.
– E.C. 1.6: las cuales actúan en el NADH o en el NADPH.
– E.C. 1.7: las cuales actúan sobre otros compuestos nitrogenados como donadores.
– E.C. 1.8: las cuales actúan sobre los grupos sulfurados de los donadores.
– E.C. 1.9: las cuales actúan en los grupos hemo de los donadores.
– E.C. 1.10: las cuales actúan en donadores como difenoles y otras sustancias relacionadas.
– E.C. 1.11: las cuales actúan sobre peróxido como aceptor.
– E.C. 1.12: las cuales actúan sobre el hidrógeno como donador.
– E.C. 1.13: las cuales actúan sobre donadores sencillos con la incorporación de oxígeno molecular (oxigenasas).
– E.C. 1.14: las cuales actúan sobre donadores “apareados”, con la incorporación o la reducción de oxígeno molecular.
– E.C. 1.15: las cuales actúan sobre superóxidos como aceptores.
– E.C. 1.16: las cuales oxidan iones metálicos.
– E.C. 1.17: las cuales actúan sobre grupos CH o CH2.
– E.C. 1.18: las cuales actúan sobre proteínas que contienen hierro y asufre como donadoras.
– E.C. 1.19: las cuales actúan sobre flavodoxina reducida como donador.
– E.C. 1.20: las cuales actúan sobre donadores como el fósforo y el arsénico.
– E.C. 1.21: las cuales actúan en la reacción X-H + Y-H = X-Y.
– E.C. 1.22: las cuales actúan sobre el halógeno de los donadores.
– E.C. 1.23: las cuales reducen los grupos C-O-C como aceptores.
– E.C. 1.97: otras oxidorreductasas.
Cada una de estas categorías incluye, además, subgrupos en los cuales se separan las enzimas de acuerdo con la preferencia de sustratos.
Por ejemplo, dentro del grupo de las oxidorreductasas que actúan sobre los grupos CH-OH de sus donadores existen unas que prefieren NAD+ o NADP+ como aceptores, mientras que otras utilizan citocromos, oxígeno, azufre, etc.
Como el grupo de las oxidorreductasas es sumamente diverso, establecer una característica estructural definida resulta bastante complicado. Su estructura no solo varía de enzima a enzima, sino que también entre especies o grupo de seres vivos e incluso de célula a célula en tejidos diferentes.
La enzima piruvato deshidrogenasa, por ejemplo, es un complejo compuesto por tres subunidades catalíticas unidas secuencialmente y conocidas como la subunidad E1 (piruvato deshidrogenasa), la subunidad E2 (dihidrolipoamida acetiltransferasa) y la subunidad E3 (dihidrolipoamida deshidrogenasa).
Cada una de estas subunidades, a su vez, puede estar compuesta por más de un monómero proteico del mismo tipo o de tipos diferentes, es decir, pueden ser homodiméricas (las que tienen solo dos monómeros iguales), heterotriméricas (las que tienen tres monómeros distintos) y así sucesivamente.
No obstante, usualmente se trata de enzimas compuestas por hélices alfa y láminas β-plegadas dispuestas de diferentes formas, con interacciones intra- e intermoleculares específicas de diferentes tipos.
Las enzimas oxidorreductasas catalizan reacciones de óxido-reducción virtualmente en todas las células de todos los seres vivos sobre la biósfera. Estas reacciones son generalmente reversibles, en las cuales el estado de oxidación de uno o más átomos dentro de la misma molécula se ve alterado.
Usualmente las oxidorreductasas necesitan dos sustratos, uno que actúe como donador de átomos de hidrógeno o de electrones (que se oxide) y otro que actúe como aceptor de hidrógeno o de electrones (que se reduzca).
Estas enzimas son sumamente importantes para muchos procesos biológicos en diferentes tipos de células y organismos.
Funcionan, por ejemplo, en la síntesis de la melanina (un pigmento que se forma en las células de la piel de los seres humanos), en la formación y la degradación de la lignina (compuesto estructural de las células vegetales), en el plegamiento de proteínas, etc.
Son empleadas industrialmente para modificar la textura de algunos alimentos y ejemplo de estas son las peroxidasas, las glucosas oxidasas y otras.
Además, las enzimas más destacadas de este grupo son aquellas que participan como transportadores electrónicos en las cadenas transportadoras de la membrana mitocondrial, de los cloroplastos y de la membrana plasmática interna de las bacterias, donde son proteínas transmembranales.
Existen cientos de ejemplos de enzimas oxidorreductasas en la naturaleza y en la industria. Estas enzimas, como se comentó, tienen funciones de suma importancia para el funcionamiento celular y, por lo tanto, para la vida per se.
Las oxidorreductasas no solo incluyen a las enzimas peroxidasas, lacasas, glucosa oxidasas o alcohol deshidrogenasas; también aúnan importantes complejos como la enzima gliceraldehído 3-fosfato deshidrogenasa o el complejo piruvato deshidrogenasa, etc., esenciales desde el punto de vista del catabolismo de la glucosa.
Incluye también a todas las enzimas del complejo de transporte electrónico en la membrana mitocondrial interna o en la membrana interna de las bacterias, similares a algunas de las enzimas que se encuentran en los cloroplastos de los organismos vegetales.
Las peroxidasas son enzimas muy diversas y emplean el peróxido de hidrógeno como aceptor de electrones para catalizar la oxidación de gran variedad de sustratos, entre los que se incluyen fenoles, aminas o tioles, entre otros. En sus reacciones reducen el peróxido de hidrógeno hasta producir agua.
Son muy importantes desde el punto de vista industrial, siendo la peroxidasa del rábano picante la más importante y la más estudiada de todas.
Biológicamente hablando, las peroxidasas son importantes para la eliminación de compuestos de oxígeno reactivos que pueden causar importantes daños en las células.
- Encyclopaedia Britannica. (2019). Retrieved December 26, 2019, from www.britannica.com
- Ercili-Cura, D., Huppertz, T., & Kelly, A. L. (2015). Enzymatic modification of dairy product texture. In Modifying Food Texture (pp. 71-97). Woodhead Publishing.
- Mathews, C. K., Van Holde, K. E., & Ahern, K. G. (2000). Biochemistry. Add. Wesley Longman, San Francisco.
- Nelson, D. L., Lehninger, A. L., & Cox, M. M. (2008). Lehninger principles of biochemistry. Macmillan.
- Nomenclature Committee of the International Union of Biochemistry and Molecular Biology (NC-IUBMB). (2019). Retrieved from www.qmul.ac.uk/sbcs/iubmb/enzyme/index.html
- Patel, M. S., Nemeria, N. S., Furey, W., & Jordan, F. (2014). The pyruvate dehydrogenase complexes: structure-based function and regulation. Journal of Biological Chemistry, 289(24), 16615-16623.
