Nitrito de sodio (NaNO2): estructura, propiedades, usos, riesgos
El nitrito de sodio es un sólido inorgánico cristalino formado por un ion sodio Na+ y un ion nitrito NO2–. Su fórmula química es NaNO2. Es un sólido cristalino blanco que tiende a absorber agua del ambiente, es decir, es higroscópico.
En presencia de aire se oxida lentamente a nitrato de sodio NaNO3. Posee propiedades oxidantes (oxida otros compuestos) y también reductoras (es oxidado por otros compuestos).

Está presente en el organismo del ser humano de forma natural y se emplea como conservante de carnes curadas y pescados ahumados pues evita el crecimiento de microorganismos nocivos.
Tiene un importante uso en el tratamiento de urgencia del envenenamiento con cianuro, pues disminuye el efecto tóxico y letal de dicho compuesto. Sin embargo, debe administrarse con mucha precaución y no sirve en todos los casos.
Se ha encontrado que podría prevenir infecciones en los ojos causadas por la contaminación de las lentes de contacto por microorganismos. Algunos estudios indican que su consumo con los alimentos puede causar cáncer, pero se estima que esto puede evitarse al ingerir vitamina C con dichos alimentos.
Índice del artículo
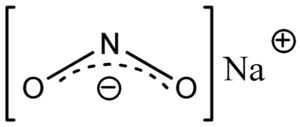
El nitrito de sodio está formado por el catión sodio Na+ y el anión nitrito NO2–.
En el anión nitrito NO2– el nitrógeno posee una valencia de +3 y el oxígeno de -2, por esta razón el anión presenta una sola carga negativa global.
El anión nitrito NO2– posee una estructura angular, esto es, los enlaces del nitrógeno (N) con los átomos de oxígeno (O) forman un ángulo.
– Nitrito de sodio
– Nitrito sódico
– Sal de sodio del ácido nitroso.
Sólido cristalino blanco amarillento. Cristales ortorrómbicos.
68,995 g/mol
271 ºC
No hierve. Se descompone por encima de 320 ºC
2,17 g/cm3 a 20 ºC
Soluble en agua: 84,8 g/100 g de agua a 25 ºC. Ligeramente soluble en etanol. Moderadamente soluble en metanol. Escasamente soluble en éter dietílico.
Sus soluciones acuosas son alcalinas, pH aproximadamente de 9. Esto se debe a que el ácido nitroso es un ácido débil que tiende a no disociarse, por lo que el ion NO2– procura tomar un protón H+ del agua para formar HNO2, lo que conduce a la formación de iones OH– que producen alcalinidad.
NO2– + H2O → HNO2 + OH–
El nitrito de sodio NaNO2 en presencia de aire se oxida lentamente a nitrato de sodio NaNO3. Es un sólido higroscópico, pues absorbe agua del ambiente.
Posee propiedades oxidantes (puede oxidar otros compuestos) y también reductoras (puede ser oxidado por otros compuestos).
Si entra en contacto con materiales como madera, papel o textiles puede hacer que entren en combustión peligrosamente.
Con ácidos se produce su descomposición, generando una mezcla de gases tóxicos marrones de óxidos de nitrógeno (NOx).
Se puede obtener calentando nitrato de sodio NaNO3 con plomo Pb:
NaNO3 + Pb → NaNO2 + PbO
El anión nitrito está presente de manera natural en la sangre y tejidos, pues se forma como consecuencia de la oxidación del NO.
Se utiliza para adobar carnes pues actúa como agente de retención de color y sabor, y como conservante pues controla el crecimiento de microorganismos, evitando en particular el desarrollo del Clostridium botulinum causante de la enfermedad del botulismo.
El nitrito de sodio en las carnes reacciona con la hemoglobina de las células rojas de la sangre o glóbulos rojos de este alimento. También se usa en pescado ahumado curado.

El nitrito de sodio se usa para el tratamiento de la intoxicación aguda con cianuro. Es un antídoto para este grave problema.
Su acción se debe a que favorece la formación de metahemoglobina (un tipo de hemoglobina) en la sangre, la cual atrapa los iones cianuro y no los suelta, y así impide que se liberen en las células, haciendo que sean menos tóxicos.
En caso de envenenamiento con cianuro se aplica el nitrito de sodio de forma intravenosa, tardando unos 12 minutos en generar metahemoglobina. A pesar de este retraso ofrece protección también por su efecto vasodilatador.
Sirve para tratar la hipertensión arterial pulmonar pues actúa dilatando los vasos sanguíneos bajando así la presión de la sangre. Se estima que este efecto se deba a que se transforma en óxido nítrico NO el cual actúa relajando la musculatura suave.
Sin embargo las causas de su efectividad aún están bajo estudio.
Ciertos investigadores hallaron que el nitrito de sodio inhibe el crecimiento y multiplicación del parásito intestinal Blastocystis hominis incluso si este es resistente a otros medicamentos.
Se encontró que el NaNO2 genera la muerte de este parásito por apoptosis, lo que es una especie de suicidio de la célula del parásito. El nitrito de sodio hace que las células intestinales produzcan NO, el cual parece ser importante en este proceso.
Según algunos estudios el nitrito es un potente inhibidor de daño al corazón e hígado en procesos de isquemia (disminución del riego sanguíneo en una parte del cuerpo). Se cree que esto se deba a que es una reserva biológica de NO.
Se concluyó que puede usarse para prevenir daños en los órganos luego de restablecer el flujo sanguíneo que ha sido interrumpido por un ataque cardíaco, intervención quirúrgica abdominal de alto riesgo o trasplante de algún órgano.
Se ha encontrado que el NaNO2 impide la formación de películas de los microorganismos patógenos Staphylococcus aureus y Pseudomonas aeruginosa sobre los lentes de contacto.

El nitrito de sodio se usa para fabricar colorantes, drogas y diversos compuestos orgánicos.
Sirve también como inhibidor de corrosión en grasas de uso múltiple.
Uno de los problemas del uso de nitrito de sodio para los envenenamientos con cianuro es que causa serios desórdenes cardiovasculares en niños.
No se recomienda para víctimas de incendios donde ocurren una exposición simultánea tanto de cianuro como a monóxido de carbono (CO). El CO reduce la capacidad de la sangre de transportar oxígeno, por lo que la administración de NaNO2 agravaría la condición de poco oxígeno en la sangre del paciente.
El nitrito de sodio inhalado es irritante y tóxico, puede dañar el sistema cardiovascular y el sistema nervioso central. Además, es dañino para el ambiente.
El nitrito de sodio ingerido con los alimentos puede ser dañino. El nitrito, al llegar al estómago, reacciona con ciertos compuestos formando nitrosaminas, las cuales pueden producir cáncer.
Estas reacciones se pueden evitar en presencia de vitamina C.
Según ciertas fuentes consultadas, el riesgo de consumir nitritos con carnes o pescados curados es mínimo debido a que el nitrito está presente de forma natural en la saliva.
Indican las fuentes que este riesgo además es mínimo comparado con los grandes beneficios de consumir alimentos libres de microorganismos nocivos.
- Bhattacharya, R. and Flora, S.J.S. (2015). Cyanide Toxicity and its Treatment. In Handbook of Toxicology of Chemical Warfare Agents (Second Edition). Recuperado de sciencedirect.com.
- U.S. National Library of Medicine. (2019). Sodium nitrite. Recuperado de: pubchem.ncbi.nlm.nih.gov.
- Kim, D.J. et al. (2017). The Antibiofilm efficacy of nitric oxide on soft contact lenses. BMC Ophthalmol 17, 206 (2017). Recuperado de bmcophthalmol.biomedcentral.com.
- Ramis-Ramos, G. (2003). Antioxidants. Synthetic Antioxidants. In Encyclopedia of Food Sciences and Nutrition (Second Edition). Recuperado de sciencedirect.
- Barozzi Seabra, A. and Durán, N. (2017). Nitric Oxide Donors for Treating Neglected Diseases. In Nitric Oxide Donors. Recuperado de sciencedirect.com.
- Duranski, M.R. et al. (2005). Cytoprotective effects of nitrite during in vivo ischemia-reperfusion of the heart and liver. J Clin Invest 2005; 115(5): 1232-1240. Recuperado de ncbi.nlm.nih.gov.
- Cotton, F. Albert and Wilkinson, Geoffrey. (1980). Advanced Inorganic Chemistry. Fourth Edition. John Wiley & Sons.
