Fucosa: características, estructura, funciones
La fucosa (abreviada Fuc), o 6-L-desoxi-galactosa, es un monosacárido parcialmente desoxigenado (desoxiazúcar) de seis carbonos cuya fórmula empírica es C6H12O5. Como otros monosacáridos, es un azúcar polihidroxilado.
Cuando un grupo hidroxilo es reemplazado por un átomo de hidrógeno, se deriva un desoxiazúcar. Aunque teóricamente este reemplazo podría afectar a cualquier grupo hidroxilo de cualquier monosacárido, en la naturaleza hay poca variedad de desoxiazúcares.
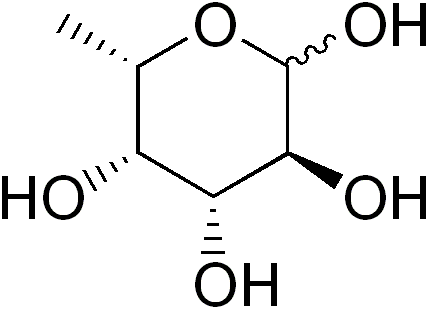
Algunos desoxiazúcares son: 1) la desoxiribosa (2-desoxi-D-ribosa), derivada de la D-ribosa, que forma parte del ADN; 2) la ramnosa (6-D-desoxi-manosa), derivada de la D-manosa; 3) la fucosa, derivada de la L-galactosa. Esta última es más frecuente que la D-fucosa, derivada de la D-galactosa.
Índice del artículo
- 1 Características y estructura
- 2 Distribución en la naturaleza
- 3 Metabolismo de la fucosa
- 4 Funciones
- 5 Referencias
La fucosa también se conoce con los nombres 6-desoxi-galacto-hexosa, fucopiranosa, galactometilosa y rodeosa.
Aunque normalmente se encuentra formando polisacáridos y glicoproteínas, aislada como monosacárido es más dulce que la galactosa. Ello se debe a que el reemplazo de un grupo hidroxilo por un átomo de hidrógeno incrementa el carácter hidrofóbico y, por ende, la dulzura de la molécula.
Los grupos hidroxilo de la fucosa pueden experimentar las mismas reacciones que otros azúcares, produciéndose una gran variedad de acetales, glicósidos, éteres y ésteres.
Una biomolécula fucosilada es aquella a la cual, por acción de una fucosiltransferasa, se han unido, mediante enlaces glicosídicos, moléculas de fucosa. Cuando se produce la hidrólisis de enlaces glicosídicos por acción de una fucosidasa, separándose así la fucosa, se dice que la biomolécula ha sido defucosilada.
Al fucosilarse los glucanos, se generan glucanos más complejos denominados fucanos, que pueden o no formar parte de glicoproteínas. Los fucanos sulfatados se definen como aquellos polisacáridos que contienen residuos sulfatados de L-fucosa. Son típicos de las algas pardas. Como ejemplos pueden nombrarse el ascofilano, el sargasano y el pelvetano.
Uno de los fucanos mejor estudiados es el fucoidano, obtenido del alga parda Fucus vesiculosus, que ha sido comercializado (Sigma-Aldrich Chemical Company) desde hace décadas.
La D-fucosa está presente en substancias antibióticas producidas por microbios, y en glicósidos vegetales, tales como la convolvulina, la chartreusina, la ledienosida y la queirotoxina.
La L-fucosa es un constituyente de los polisacáridos de las algas, las hojas del ciruelo, las semillas de lino, soya y canola, la goma de tragacanto, las paredes celulares de la patata, los tubérculos de la mandioca, la fruta kiwi, la corteza de la ceiba y el mucigel de la caliptra del maíz, así como otras plantas.
La L-fucosa también está presente en los huevos de erizos de mar y en la gelatina que protege los huevos de rana.
En los mamíferos, los fucanos con L-fucosa forman los ligandos que actúan en la adhesión leucocito-endotelial mediada por selectina, y participan en numerosos eventos ontogenéticos.
La L-fucosa abunda en los fucoesfingolípidos del epitelio gastrointestinal y la médula ósea, y aparece en proporciones pequeñas en el cartílago y en estructuras queratinosas.
En los humanos, los fucanos con L-fucosa forman parte de glicoproteínas de la saliva y los jugos gástricos. También forman parte de los antígenos que definen los grupos sanguíneos ABO. Están presentes en varios oligosacáridos de la leche materna.
Las fucosiltransferasas utilizan la GDP-fucosa, una forma de fucosa activada por nucleótidos, como donante de fucosa en la construcción de oligosacáridos fucosilados.
La GDP-fucosa se deriva de la GDP-manosa por la acción sucesiva de dos enzimas: la GDP-manosa 4,6-deshidratasa y la GDP-4-ceto-6-desoximanosa 3,5-epimerasa-4-reductasa.
Uitlizando un cofactor NADP+, la primera enzima cataliza la deshidratación de la GDP-manosa. La reducción de la posición 6 y oxidación de la posición 4 produce la GDP-6-desoxi-4-ceto-manosa (durante la reacción, el híbrido es transferido de la posición 4 a la 6 del azúcar).
La segunda enzima, que es NADPH dependiente, catalyza la epimerización de las posiciones 3 y 5, y la redución del grupo 4-ceto, de la GDP-6-desoxi-4-ceto-manosa.
Las bacterias pueden crecer utilizando fucosa como fuente única de carbono y energía por medio de un operón inducible por fucosa que codifica enzimas catabólicas para esta azúcar.
El proceso anterior involucra: 1) entrada de fucosa libre a través de la pared celular con mediación de una permeasa; 2) isomerización de la fucosa (una aldosa) para formar fuculosa (una cetosa); 3) fosforilación de la fuculosa para formar fuculosa-1-fosfato; 4) una reacción aldolasa para formar lactaldehido y fosfato de dihidroxiacetona a partir de la fuculosa-1-fosfato.
Entre los síntomas de muchos tipos de tumor cancerígeno se encuentran la presencia de proteínas unidas a glucanos que se distinguen por poseer una composición de oligosacáridos alterada. La presencia de estos glucanos anormales, entre los cuales destacan los fucanos, está vinculada a la malignidad y potencial metastásico de dichos tumores.
En el cáncer mamario, las células tumorales incorporan fucosa a las glicoproteínas y glicolípidos. La fucosa contribuye a la progresión de este cáncer, favoreciendo la activación de las células madre cancerosas, la metástasis hematogénica y la invasión de tumores a través de matrices extracelulares.
En el carcinoma pulmonar y la hepatocarcinogénesis, la expresión aumentada de la fucosa está vinculada con un potencial metastásico elevado y con baja probabilidad de supervivencia.
Como contrapartida, algunos fucanos sulfatados son substancias prometedoras en el tratamiento del cáncer, tal como lo han determinado numerosos estudios in vitro con líneas de células cancerosas, incluyendo aquellas causantes de cáncer mamario, pulmonar, prostático, gástrico, de colon y recto.
La expresión aumentada de fucanos en las inmunoglobulinas séricas ha sido relacionado con la artritis reumatoide juvenil y adulta.
La deficiencia en la adhesión de leucocitos II es una enfermedad congénita rara debida a mutaciones que alteran la actividad de un transportador de FDP-fucosa localizado en el aparato de Golgi.
Los pacientes sufren de retardo mental y psicomotor, y sufren infecciones bacterianas recurrentes. Esta enfermedad responde favorablemente a dosis orales de fucosa.
Los fucanos sulfatados obtenidos de las algas pardas son importantes reservorios de compuestos con potencial terapéutico.
Tienen propiedades antiinflamatorias y antioxidantes, inhibiendo la migración de linfocitos en sitios de infección y favoreciendo la liberación de citoquinas. Incrementan la respuesta inmune mediante la activación de los linfocitos y macrófagos.
Tienen propiedades anticoagulantes. Se ha comprobado en pacientes humanos que por vía oral inhiben la agregación plaquetaria.
Tienen potencial antibiótico y antiparasitario e inhiben el crecimiento de la bacteria patógena estomacal Helicobacter pylori. Mata a los parásitos Plasmodium spp. (agente causal de la malaria) y Leishmania donovani (agente causal de la leishmaniasis viscerotrópica americana).
Finalmente, tienen potentes propiedades antivirales, inhibiendo la entrada a la célula de varios virus de gran importancia para la salud humana, incluyendo Arenavirus, Cytomegalovirus, Hantavirus, Hepadnavirus, HIV, virus del herpes simplex, y virus de la influenza.
- Becker, D. J., Lowe, J. B. 2003. Fucose: biosynthesis and biological function in mammals. Glycobiology, 13, 41R–53R.
- Deniaud-Bouët, E., Hardouin, K., Potin, P., Kloareg, B., Hervé, C. 2017. A review about brown algal cell walls and fucose-containing sulfated polysaccharides: cell wall context, biomedical properties and key research challenges.Carbohydrate Polymers, http://dx.doi.org/10.1016/j.carbpol.2017.07.082.
- Flowers H. M. 1981. Chemistry and biochemistry of D- and L-fucose. Advances in Carbohydrate Chemistry and Biochemistry, 39, 279–345.
- Listinsky, J. J., Siegal, G. P., Listinsky, C. M. 2011. The emerging importance of α-L-fucose in human breast cancer: a review. Am. J. Transl. Res., 3, 292–322.
- Murray, R. K., et al. 2003. Harper’s illustrated biochemistry. McGraw-Hill, Nueva York.
- Pereira, L. 2018. Therapeutic and nutritional uses of algae. CRC Press, Boca Raton.
- Staudacher, E., Altmann, F., Wilson, I. B. H., März, L. 1999. Fucose in N-glycans: from plant to man. Biochimica et Biophysica Acta, 1473, 216–236.
- Tanner, W., Loewus, F. A. 1981. Plant carbohydrates II. Extracellular carbohydrates. Springer, Nueva York.
- Vanhooren, P. T., Vandamme, E. J. 1999. L-fucose: occurrence, physiological role, chemical, enzymatic and microbial synthesis. Journal of Chemical Technology and Biotechnology, 74, 479–497.
