Teorías de ácidos-bases: Arrhenius, Bronsted-Lowry, Lewis

¿Qué son las teorías de ácidos y bases?
Las teorías de ácidos y bases son un conjunto de aportaciones conceptuales que definen y diferencian los ácidos y las bases, dos conglomerados de sustancias de inmensa relevancia en los campos de la química.
Sus raíces provienen de las primeras caracterizaciones realizadas por Robert Boyle en 1661, quien definió los ácidos como sustancias agrias y corrosivas que cambian el color del papel tornasol de azul a rojo; y las bases como sustancias jabonosas que, a diferencia de los ácidos, cambian el color del papel tornasol de rojo a azul.
Antoine Lavoisier propuso que todos los ácidos contenían átomos de oxígeno, tales como el H2SO4 y HNO3. Siglos después en 1811 Humphry Davy encontró que muchos ácidos en realidad no poseían átomos de oxígeno, tales como HCl, HF, HBr, etc.
Y poco antes de la aparición de la famosa tríada ácido-base (imagen superior), Justig Liebig sugirió que los ácidos tienen átomos de hidrógeno que pueden ser sustituidos por cationes metálicos.
Estos conocimientos empíricos sirvieron de inspiración para las actuales teorías de los ácidos y bases: Arrhenius, Bronsted-Lowry y Lewis. Tal como se ve en el gráfico, la teoría de Arrhenius es la más restrictiva o limitada de todas, mientras la de Lewis es la más general y globalizada.
Teoría de Arrhenius
Propuesta por los años 1884 por Svante Arrhenius, su teoría dice que los ácidos cuando se disuelven en agua producen iones H3O+ o H+; mientras que las bases, al disolverse en agua, producen o liberan iones OH–.
Los iones H3O+ y OH– se combinan en una reacción reversible que da lugar a moléculas de agua:
H3O+ + OH– ⇌ 2H2O
Entonces, un ácido de Arrhenius también es aquel que aumenta la concentración de iones H3O+, mientras una base de Arrhenius es aquella que aumenta la concentración de iones OH–.
Esto significa que un ácido de Arrhenius no necesariamente debe contener iones H3O+, y una base de Arrhenius no tiene por qué tener iones OH– en su estructura.
Ejemplo y limitaciones
Considérese las siguientes disociaciones:
HCl(ac) → H+(ac) + Cl–(ac)
NaOH(ac) → Na+(ac) + OH–(ac)
El HCl es un ácido de Arrhenius porque cuando está disuelto en el agua produce iones H+, o más correctamente, iones H3O+. Y por el otro lado, NaOH es una base de Arrhenius porque cuando está disuelta en el agua libera iones OH–. Estas sustancias reaccionan entre sí para producir sal y agua:
HCl(ac) + NaOH(ac) → NaCl(ac) + H2O
El problema con la teoría de Arrhenius radica en el hecho de que se limita solo a las disoluciones acuosas, y por lo tanto, aplica solo para las sustancias que son solubles en agua. Por ejemplo, el MgO es muy insoluble en el agua, y sin embargo es un óxido básico.
Asimismo, es incapaz de explicar por sí sola cómo sustancias como el NH3 y CaO producen iones OH– disueltos en agua, aun cuando no tengan iones OH– en su estructura molecular o cristalina (como es el caso del NaOH o KOH).
Y tampoco explica cómo el CO2 puede liberar iones H3O+ en agua sin tener ningún átomo de hidrógeno en su estructura molecular (como es el caso del HCl o H2SO4).
Teoría de Brönsted-Lowry
Propuesta individualmente en 1923 por Johannes Bronsted y Thomas Lewry, su teoría de los ácidos y bases dice que un ácido es toda aquella sustancia que puede donar iones H+, y que una base en cambio es toda sustancia que sea capaz de aceptar estos H+. Esta teoría es más general que la de Arrhenius y cubre varias de sus limitaciones.
Ejemplo
Considérese de nuevo la ecuación de neutralización entre H3O+ y un OH– para producir dos moléculas de agua:
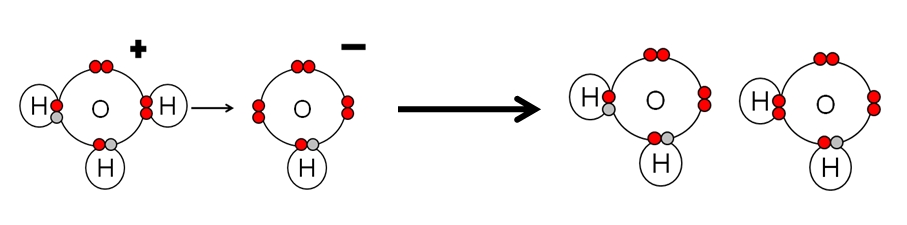
Nótese que el H3O+ dona un H+ que inmediatamente pasa a enlazarse o coordinarse con el OH– justo a la derecha. Cuando el H+ termina enlazado a uno de los pares libres de electrones del O en el OH–, quedan como productos dos moléculas de agua neutras.
El H3O+ por lo tanto es un ácido de Bronsted-Lowry, por donar el H+, y el OH– es una base de Bronsted-Lowry por aceptar este H+.
Otro ejemplo de una reacción ácido-base es la siguiente:
NH3(g) + HCl(g) → NH4Cl(s)
Esta reacción, según Arrhenius, no podría considerarse del tipo ácido-base porque no transcurre en medio acuoso sino en fase de vapor o en estado gaseoso. El NH3 es una base de Bronsted porque acepta el H del HCl al donarle un par de electrones ubicado sobre el átomo de nitrógeno; y el HCl, por lógica, viene a ser el ácido de Bronsted.
Así, el MgO es una base de Bronsted porque es capaz de aceptar H+ de ácidos para transformarse en Mg(OH)2.
Teoría de Lewis
La teoría de Bronsted-Lowry explica un amplio espectro de las reacciones ácido-base. Sin embargo, ignora aquellas reacciones donde los iones H+ y OH– no estén involucrados en absoluto, así como una mayor participación de los pares de electrones libres en mecanismos moleculares.
Es así pues, que en 1923 G. N. Lewis propuso una teoría ácido-base que dice lo siguiente: un ácido es toda sustancia que es capaz de aceptar pares de electrones, mientras una base es aquella que dona estos pares de electrones.
Por ejemplo, el ion H+ es un ácido de Lewis porque acepta pares de electrones de cualquier especie alrededor: del H2O para originar H3O+, del NH3 para originar NH4+, etc.
Ejemplo y ventajas
Considérese otro ejemplo en la siguiente reacción:

El NH3 dona un par de electrones (azul) del átomo de nitrógeno al átomo de boro del BF3. Por lo tanto, el NH3 es la base de Lewis porque dona el par de electrones, y el BF3 es el ácido de Lewis porque los acepta.
Por lo general, los cationes y las especies deficientes de electrones son ácidos de Lewis, mientras que los aniones y las especies ricas en electrones son bases de Lewis.
Las ventajas que ofrecen la teoría ácido-base de Lewis es que engloba todas las demás.
Por ejemplo: el H2O tiene pares de electrones libres en el oxígeno. Si dona uno de ellos hacia un ion H+, actuará como una base de Lewis, siendo el H+ por consiguiente el ácido de Lewis.
Según Bronsted-Lowry, el H2O estaría actuando como una base porque precisamente está aceptando el H+ al donarle un par de sus electrones libres. Y finalmente, el H2O también es una base según la teoría de Arrhenius porque está disminuyendo la concentración de iones H+ en el medio acuoso, y aumentando en consecuencia la concentración de iones OH–.
Referencias
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Clark Jim. (2002). Theories of Acids and Bases. Recuperado de: chemguide.co.uk
- Broderick C., Moussa M., & Clark J. (21 de agosto de 2020). Overview of Acids and Bases. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
- Wikipedia. (2020). Acid-base reaction. Recuperado de: en.wikipedia.org
- Texas A&M University. (s.f.). Acids and Bases: Development of Acids and Bases. Recuperado de: chem.tamu.edu
