Bencilo: hidrógenos bencílicos, carbocationes, radicales bencílicos
El bencilo o bencil es un grupo sustituyente común en química orgánica cuya fórmula es C6H5CH2– o Bn-. Estructuralmente consiste simplemente en la unión de un grupo metileno, CH2, con un grupo fenilo, C6H5; es decir, un carbono sp3 enlazado directamente a un anillo bencénico.
Por lo tanto, el grupo bencilo puede verse como un anillo aromático unido a una pequeña cadena. En algunos textos se prefiere el uso de la abreviatura Bn en lugar del C6H5CH2-, reconociéndosele fácilmente en cualquier compuesto; en especial, cuando está unido a un átomo de oxígeno o nitrógeno, O-Bn o NBn2, respectivamente.
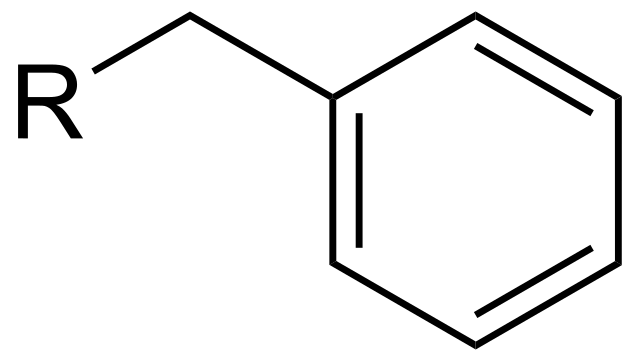
Este grupo se encuentra también de manera implícita en una serie de compuestos ampliamente conocidos. Por ejemplo, al ácido benzoico, C6H5COOH, se pudiera considerar como un bencilo cuyo carbono sp3 ha sufrido una exhaustiva oxidación; o benzaldehído, C6H5CHO, de una oxidación parcial; y alcohol bencílico, C6H5CH2OH, todavía menos oxidado.
Otro ejemplo un tanto evidente de este grupo se haya en el tolueno, C6H5CH3, el cual puede sufrir determinado número de reacciones a raíz de la inusual estabilidad resultante de los radicales o carbocationes bencílicos. Sin embargo, el grupo bencilo sirve para proteger los grupos OH o NH2 de reacciones que modifiquen indeseablemente el producto a sintetizar.
Índice del artículo
- 1 Ejemplos de compuestos con grupo bencilo
- 2 Hidrógenos bencílicos
- 3 Carbocationes y radicales bencílicos
- 4 Reacciones
- 5 Referencias
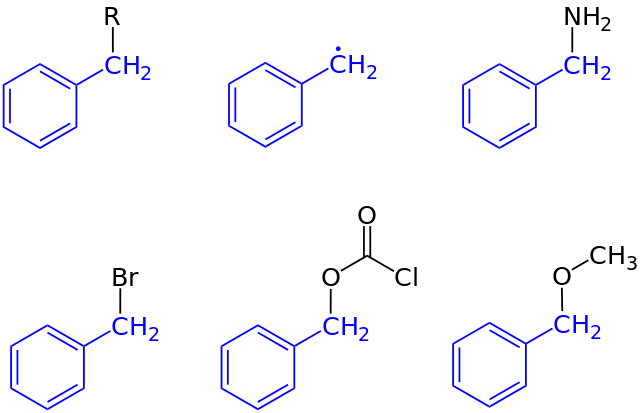
En la primera imagen se mostró la representación general de un compuesto con un grupo bencilo: C6H5CH2-R, donde R puede ser cualquier otro fragmento molecular o átomo. Así, variando R puede obtenerse un alto número de ejemplos; algunos simples, otros apenas para una región específica de una estructura o conjunto mayor.
El alcohol bencílico, por ejemplo, deriva de sustituir R por OH: C6H5CH2-OH. Si en lugar de OH se trata del grupo NH2, entonces surge el compuesto bencilamina: C6H5CH2-NH2.
Si es el Br el átomo que sustituye a R, el compuesto originado es el bromuro de bencilo: C6H5CH2-Br; R por CO2Cl origina un éster, el clorocarbonato de bencilo (o cloruro de carbobenzoxilo); y OCH3 origina el bencil metil éter, C6H5CH2-OCH3.
Inclusive (aunque no correctamente del todo), R puede suponerse por un electrón solitario: el radical bencílico, C6H5CH2·, producto de la liberación del radical R·. Otro ejemplo, si bien no está incluido en la imagen, es el fenilacetonitrilo o cianuro de bencilo, C6H5CH2-CN.
Hay compuestos donde el grupo bencilo apenas representa una región específica. Cuando es así, se suele utilizar la abreviatura Bn para simplificar la estructura y sus ilustraciones.
Los compuestos anteriores tienen en común no solo el anillo aromático o fenílico, sino además hidrógenos bencílicos; estos son los que pertenecen al carbono sp3.
Tales hidrógenos pueden representarse como: Bn-CH3, Bn-CH2R o Bn-CHR2. El compuesto Bn-CR3 carece de hidrógeno bencílico, y por tanto, su reactividad es menor que la de los otros.
Estos hidrógenos son diferentes a los que usualmente se hallan enlazados a un carbono sp3.
Por ejemplo, considérese el metano, CH4, el cual también puede escribirse como CH3-H. Para que se rompa el enlace CH3-H en una ruptura heterolítica (formación de radicales), debe suministrarse una determinada cantidad de energía (104kJ/mol).
No obstante, la energía para la misma ruptura del enlace C6H5CH2-H es menor en comparación a la del metano (85 kJ/mol). Al ser menor dicha energía, implica que el radical C6H5CH2· es más estable que CH3·. Lo mismo sucede en mayor o menor grado con otros hidrógenos bencílicos.
En consecuencia, los hidrógenos bencílicos son más reactivos al generar radicales o carbocationes más estables que los originados por otros hidrógenos. ¿Por qué? La pregunta se responde en el siguiente apartado.
Se consideró ya el radical C6H5CH2·, faltando el carbocatión bencílico: C6H5CH2+. En el primero hay un electrón desapareado y solitario, y en el segundo una deficiencia electrónica. Las dos especies son muy reactivas, y representan compuestos transitorios de los cuales se originan los productos finales de la reacción.
El carbono sp3, luego de perder uno o dos electrones para formar el radical o carbocatión, respectivamente, puede adoptar la hibridación sp2 (plano trigonal), de tal manera que haya la menor repulsión posible entre sus grupos electrónicos. Pero, si pasa a ser sp2, al igual que los carbonos del anillo aromático, ¿puede ocurrir una conjugación? La respuesta es sí.
Esta conjugación o resonancia es el factor clave para explicar la estabilidad de estas especies bencílicas o derivadas del bencilo. En la imagen siguiente se ilustra tal fenómeno:
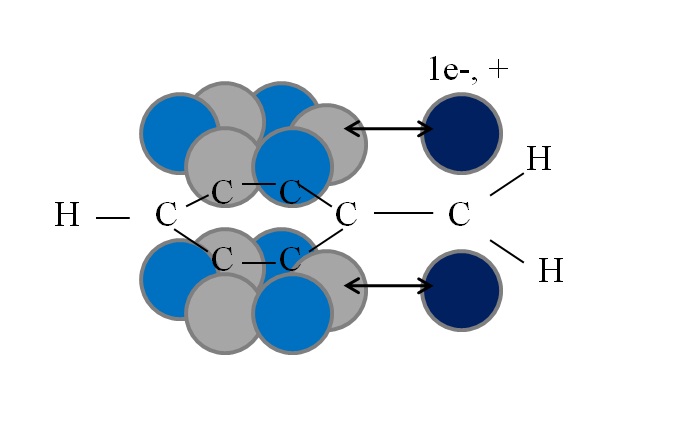
Nótese que donde estaba uno de los hidrógenos bencílicos quedó un orbital p con un electrón desapareado (radical, 1e–), o vacío (carbocatión, +). Como puede apreciarse, este orbital p se encuentra paralelo al sistema aromático (los círculos grises y azules claro), con la doble flecha indicando el inicio de la conjugación.
Así, tanto el electrón desapareado como la carga positiva pueden transferirse o dispersarse por el anillo aromático, ya que el paralelismo de sus orbitales lo favorece geométricamente. Sin embargo, estos no se sitúan en cualquier orbital p del anillo aromático; únicamente en aquellos pertenecientes a los carbonos en posiciones orto y para respecto al CH2.
Es por eso que los círculos azules claro destacan por encima de los grises: en ellos se concentran la densidad negativa o positiva del radical o carbocatión, respectivamente.
Cabe mencionar, que esta conjugación o resonancia no puede darse en carbonos sp3 más distantes del anillo aromático.
Por ejemplo, el radical C6H5CH2CH2· es mucho más inestable debido a que el electrón desapareado no puede conjugarse con el anillo al interponerse el grupo CH2 de por medio y con hibridación sp3. Lo mismo ocurre con C6H5CH2CH2+.
En resumen: los hidrógenos bencílicos son propensos a reaccionar, ya sea generando un radical o un carbocatión, lo que terminan a su vez originando el producto final de la reacción. Por lo tanto, reaccionan mediante un mecanismo SN1.
Un ejemplo consiste en la bromación del tolueno bajo radiación ultravioleta:
C6H5CH3 + 1/2Br2 => C6H5CH2Br
C6H5CH2Br + 1/2Br2 => C6H5CHBr2
C6H5CHBr2 + 1/2Br2 => C6H5CBr3
De hecho, en esta reacción se producen radicales Br·.
Por otro lado, el grupo bencilo de por sí reacciona para proteger los grupos OH o NH2 en una simple reacción de sustitución. Así, un alcohol ROH puede ser ‘benzilado’ utilizando bromuro de bencilo y otros reactivos (KOH o NaH):
ROH + BnBr => ROBn + HBr
ROBn es un éter bencílico, al cual puede retornársele su grupo OH inicial si se le somete a un medio reductivo. Este éter debe permanecer inalterado mientras otras reacciones se llevan a cabo en el compuesto.
- Morrison, R.T. y Boyd, R. N. (1987). Química Orgánica. (5ta Edición). Addison-Wesley Iberoamericana.
- Carey, F. A. (2008). Química Orgánica. (6ta Edición). McGraw-Hill, Interamerica, Editores S.A.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. Amines. (10th edition.). Wiley Plus.
- Wikipedia. (2019). Benzyl group. Recuperado de: en.wikipedia.org
- Dr. Donald L. Robertson. (05 de diciembre de 2010). Phenyl or Benzyl? Recuperado de: home.miracosta.edu
- Gamini Gunawardena. (12 de octubre de 2015). Benzylic Carbocation. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
