Redes de Bravais: concepto, características, ejemplos, ejercicios
Las redes de Bravais son el conjunto de las catorce celdas unitarias tridimensionales en las que pueden ubicarse los átomos de un cristal. Estas celdas constan de un arreglo tridimensional de puntos que forman una estructura básica que se repite periódicamente en las tres direcciones espaciales.
El origen de esta denominación para las estructuras cristalinas básicas proviene de 1850, cuando Auguste Bravais demostró que solo hay 14 celdas unitarias básicas tridimensionales posibles.
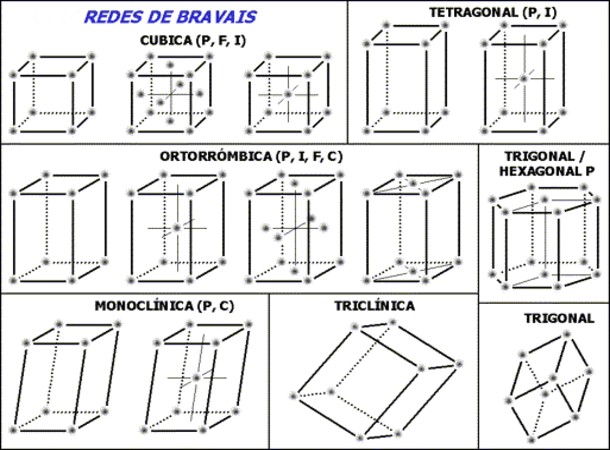
El conjunto de las 14 redes de Bravais se subdividen en siete grupos o estructuras de acuerdo a la geometría de las celdas, estos siete grupos son:
1- Cúbico
2- Tetragonal
3- Ortorrómbico
4- Trigonal-Hexagonal
5- Monoclínico
6- Triclínico
7- Trigonal
Cada una de estas estructura definen una celda unitaria, siendo esta la porción más pequeña que conserva la disposición geométrica de los átomos en el cristal.
Índice del artículo
Las catorce redes de Bravais, como se dijo más arriba, se subdividen en siete grupos. Pero cada uno de estos grupos tiene sus celdas unitarias con sus parámetros característicos los cuales son:
1- El parámetro de red (a, b, c)
2- Número de átomos por celda
3- Relación entre parámetro de red y radio atómico
4- Número de coordinación
5- Factor de empaquetamiento
6- Espacios intersticiales
7- Mediante traslaciones a lo largo de los vectores a, b, c la estructura cristalina se repite.
Consta de la red cúbica simple o cúbica P, red cúbica centrada en las caras o red cúbica F y la red cúbica centrada en el cuerpo o red cúbica I.
Todas las redes cúbicas tienen los tres parámetros de red correspondientes a las direcciones x, y, z del mismo valor:
a = b = c
Red cúbica P
Es conveniente resaltar que los átomos se representan por esferas cuyos centros están en los vértices de la celda unitaria cúbica P.
En el caso de la red cúbica P el número de átomos por celda es 1, debido a que en cada vértice sólo la octava parte del átomo está dentro de la celda unitaria, entonces 8*⅛ = 1.
El número de coordinación indica el número de átomos que son vecinos próximos en la red cristalina. En el caso de la red cúbica P el número de coordinación es 6.
Red cúbica I
En este tipo de red además de los átomos en los vértices del cubo, se tiene un átomo en el centro del cubo. Por lo que el número de átomo por celda unitaria en la red cúbica P es de 2 átomos.

Red cúbica F
Es la red cúbica que además de los átomos en los vértices tiene un átomo en el centro de la cara de cada cubo. El número de átomos por celda es 4, ya que cada uno de seis átomos de la cara tiene la mitad dentro de la celda es decir 6*½ = 3 más 8*⅛=1 en los vértices.

Red hexagonal
En este caso la celda unitaria es un prisma recto de base hexagonal. Las redes hexagonales tienen los tres parámetros de red correspondientes cumpliendo la siguiente relación:
a = b ≠ c
Siendo el ángulo entre el vector a y el b de 120º, tal como se muestra en la figura. Mientras que entre los vectores a y c, así como entre el b y el c se forman ángulos rectos.

El número de átomos por celda se calculará de la siguiente manera:
– En cada una de las 2 bases del prisma hexagonal hay 6 átomos en los seis vértices. Cada uno de estos átomos ocupa ⅙ de la celda unitaria.
– En el centro de cada una de las 2 bases hexagonal hay 1 átomo que ocupa 1/2 celda unitaria.
– En las 6 caras laterales del prisma hexagonal hay 3 átomos cada uno de los cuales ocupa ⅔ de la celda unitaria, y 3 átomos que ocupan cada uno ⅓ de volumen de la celda unitaria.
(6 x ⅙ )x 2 + ½ x 2 + ⅔ x 3 + ⅓ x 3 = 6
La relación entre los parámetros de red a y b con el radio atómico R bajo el supuesto que todos los átomos son de igual radio y están en contacto es:
a/R = b/R = 2
Los metales son los principales ejemplos de estructuras cristalinas y también las más simples porque generalmente constan de un solo tipo de átomo. Pero hay otros compuestos no metálicos que también forman estructuras cristalinas, como el diamante, el cuarzo y muchos otros.
El hierro tiene una celda unidad cúbica simple con parámetro de red o arista a = 0,297 nm. En 1 mm hay 3,48 x 10^6 celdas unitarias.
Tiene una estructura cristalina cúbica centrada en las caras, conformada únicamente por átomos de cobre.
Las gemas preciosas son estructuras cristalina de básicamente un mismo compuesto, pero con pequeñas porciones de impurezas que muchas veces son las responsables del colorido de las mismas.
Diamante
Está compuesto únicamente de carbono y no contiene impurezas, razón por la cual carece de color. El diamante tiene estructura cristalina cúbica (isométrico-hexoctaédrico) y es el material más duro conocido.
Cuarzo
Está compuesto de óxido de sílice, generalmente es incoloro o blanco. Su estructura cristalina es trigonal-trapezoédrica.
Rubí
Está compuesto de óxido de aluminio con impurezas de cromo que le dan su característico color rojo. Forma una red cristalina hexagonal.
Zafiro
Es también un cristal de óxido de aluminio, pero con impurezas de titanio y hierro, que son responsable de su color azul en diversas tonalidades. Al igual que el rubí tiene estructura hexagonal.
Jade
Piedra preciosa generalmente de color verde, tiene estructura monoclínica y está compuesto de silicato de hierro-magnesio-calcio.
Es incoloro con una estructura ortorrómbica de fluoruro de aluminio-hidróxido-silicato.
Hallar la relación entre el parámetro de red y el radio atómico para una red cúbica F.
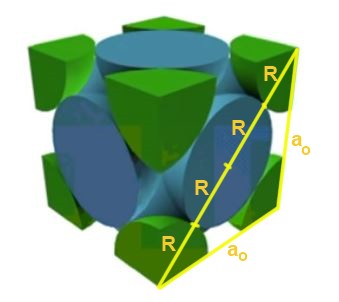
Solución: En primer lugar se supone que los átomos se representan como esferas todas de radio R en “contacto” unas con otras, como se muestra en la figura. Se forma un triángulo rectángulo en el que se cumple que:
(4 R )^2 = a^2 + a^2 = 2 a^2
Por lo que se tiene que la relación arista-radio es:
a/R = 4/√2
Hallar la relación entre el parámetro de red y el radio atómico para una red cúbica I (centrada en el cuerpo).
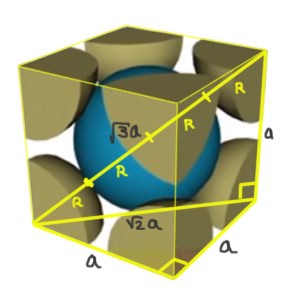
Solución: Se supone que los átomos se representan como esferas todas de radio R en “contacto” unas con otras, como se muestra en la figura.
Se forman dos triángulos rectángulos uno de hipotenusa √2a y el otro de hipotenusa √3a como puede demostrarse mediante el uso del teorema de Pitágoras. De allí se tiene que la relación entre el parámetro de red y el radio atómico para una red cúbica I (centrada en el cuerpo) es:
a/R = 4/√3
Hallar el factor de empaquetamiento F para una celda unitaria de una estructura cúbica F (cúbica centrada en las caras) en la que los átomos tienen radio R y están en “contacto”.
Solución: El factor de empaquetamiento F se define como el cociente entre el volumen ocupado por los átomos en la celda unitaria y el volumen de la celda:
F = Vátomos / Vcelda
Como se demostró más arriba, el número de átomos por celda unitaria de una red cúbica centrada en las caras es 4, por lo que el factor de empaquetamiento será:
F = 4[4πR^3 /3]/[a^3] = …
… 4[4πR^3 /3]/[4R/√2]^3 = (√2)π/6 = 0,74
- Crystal Structures Academic Resource Center. [PDF]. Recuperado el 24 de mayo de 2018, de: web.iit.edu
- Crystals. Recuperado el 26 de mayo de 2018, de: thoughtco.com
- Pressbooks. 10.6 Lattice Structures in Crystalline Solids. Recuperado el 26 de mayo de 2018, de: opentextbc.ca
- Ming. (30 de junio de 2015). Types Crystal Structures. Recuperado el 26 de mayo de 2018, de: crystalvisions-film.com
- Helmenstine, Anne Marie, Ph.D. (31 de enero de 2018). Types of
- Kittel Charles (2013) Solid State Physics, Condensed matter Physics (8th edition). Wiley.
- KHI. (2007). Crystalline Structures. Recuperado el 26 de mayo de 2018, de: folk.ntnu.no
- Wikipedia. Bravais lattices. Recuperado de: en.wikipedia.com.
