Sulfuro de cobre: estructura, propiedades, usos
El sulfuro de cobre es una familia de compuestos inorgánicos cuya fórmula química general es CuxSy. Si x es más grande que y significa que dicho sulfuro es más rico en cobre que en azufre; y si por el contrario, x es más pequeño que y, entonces el sulfuro es más rico en azufre que en cobre.
En la naturaleza predominan numerosos minerales que representan fuentes naturales de este compuesto. Casi todos ellos son más ricos en cobre que en azufre, y su composición viene expresada y simplificada por la fórmula CuxS; aquí x puede tomar incluso valores fraccionales, indicativo de un sólido no estequiométrico (Cu1.75S, por ejemplo).

Aunque en estado elemental el azufre es de color amarillo, sus compuestos derivados lucen colores oscuros; tal ocurre también con el sulfuro de cobre. Sin embargo, el mineral covelita (imagen superior), el cual se compone principalmente de CuS, exhibe brillos metálicos y una iridiscencia azulada.
Pueden prepararse a partir de diferentes fuentes de cobre y azufre, empleando para ello distintas técnicas y variando los parámetros de síntesis. Así, puede obtener nanopartículas de CuS con interesantes morfologías.
Índice del artículo
Este compuesto tiene la apariencia de ser cristalino, por lo que se puede pensar inmediatamente que se compone de iones Cu+ (cobre monovalente), Cu2+ (cobre divalente), S2- e, inclusive, S2– y S22- (aniones disulfuros), los cuales interaccionan mediante fuerzas electrostáticas o enlace iónico.
Sin embargo, existe un ligero carácter covalente entre el Cu y S, y por lo tanto, no puede descartarse el enlace Cu-S. Desde este razonamiento, la estructura cristalina del CuS (y la de todos sus sólidos derivados) comienza a diferir de las encontradas o caracterizadas para otros compuestos iónicos o covalentes.
Es decir que no puede hablarse de iones puros, sino que en medio de sus atracciones (catión-anión) hay un leve solapamiento de sus orbitales externos (compartición de electrones).
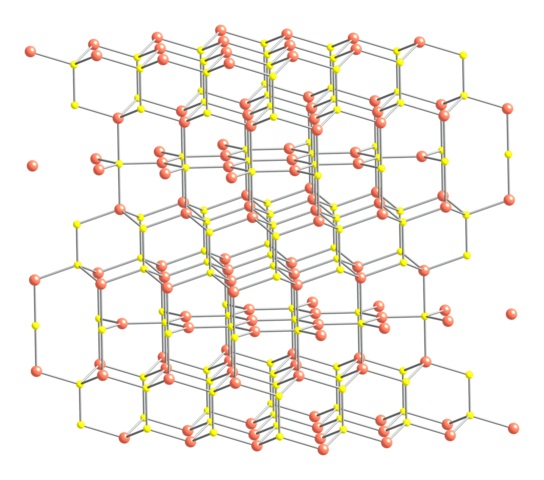
Habiendo dicho lo anterior, se muestra en la imagen superior la estructura cristalina de la covelita. Consiste de cristales hexagonales (definidos por los parámetros de sus celdas unitarias), en donde los iones se unen y orientan en distintas coordinaciones; estas son, con un número variado de vecinos cercanos.
En la imagen los iones de cobre se representan con esferas rosadas, mientras que los de azufre con esferas amarillas.
Enfocando la atención primeramente en las esferas rosadas, se notará que algunas están rodeadas por tres esferas amarillas (coordinación plano trigonal), y otras por cuatro (coordinación tetraédrica).
El primer tipo de cobre, trigonal, se puede identificar en los planos perpendiculares a las caras hexagonales que dan hacia el lector, en las cuales están a su vez el segundo tipo de carbono, tetraédrico.
Atendiendo ahora segundamente a las esferas amarillas, algunas tienen por vecinas a cinco esferas rosadas (coordinación bipirámide trigonal), y otras a tres y una esfera amarilla (nuevamente, coordinación tetraédrica); en estas últimas se está ante el anión disulfuro, el cual puede visualizarse abajo y dentro de la misma estructura de la covelita:
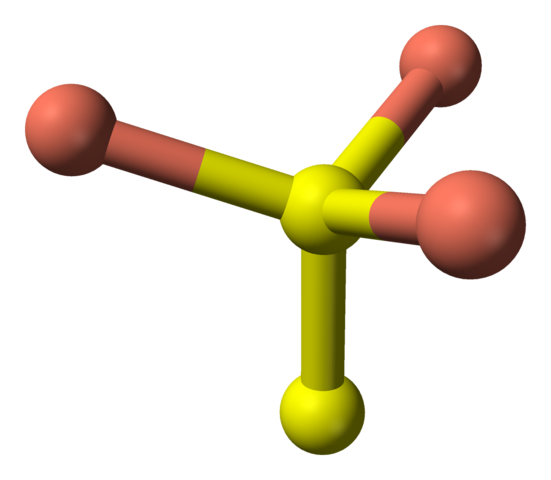
Fórmula alternativa
Hay entonces iones Cu2+, Cu+, S2- y S22-. Sin embargo, estudios realizados con espectroscopía fotoelectrónica de rayos X (XPS), señalan que todo el cobre está como cationes Cu+; y por lo tanto, la fórmula inicial CuS, se expresa “mejor” como (Cu+)3(S2−)(S2)−.
Noten que la relación Cu:S para la fórmula anterior continúa siendo 1, y además las cargas se cancelan.
Un sulfuro de cobre puede adoptar cristales ortorrómbicos, como en el polimorfo, γ-Cu2S, de la calcocita; cúbicos, como en otro polimorfo de la calcocita, α-Cu2S; tetragonales, en el mineral anilita, Cu1.75S; monoclínicos, en la djurleita, Cu1.96S, entre otros.
Para cada cristal definido se tiene un mineral, y a su vez, cada mineral tiene sus propias características y propiedades.
Las propiedades del sulfuro de cobre están sujetas a la relación Cu:S de sus sólidos. Por ejemplo, aquellos que presentan aniones S22- tienen estructuras hexagonales, y pueden ser o semiconductores o conductores metálicos.
Si por otro lado el contenido azufre consiste meramente de aniones S2-, los sulfuros se comportan como semiconductores, y presentan además conductividades iónicas a altas temperaturas. Esto se debe a que sus iones comienzan a vibrar y desplazarse dentro de los cristales, transportando así cargas eléctricas.
Ópticamente, aunque también depende de su composición de cobre y azufre, los sulfuros pueden o no absorber radiación en la región infrarrojo del espectro electromagnético. Estas propiedades ópticas y eléctricas lo hace potenciales materiales para implementarse en distintas gamas de dispositivos.
Otra variables a considerar, además de la relación Cu:S, es el tamaño de los cristales. No sólo se trata de que haya sulfuros de cobre más “azufrados” o “cobrizos”, sino que las dimensiones de sus cristales imparten un efecto impreciso sobre sus propiedades; es así que los científicos tengan afán por estudiar y buscarles aplicaciones a las nanopartículas CuxSy.
Cada mineral o sulfuro de cobre cuentan con propiedades únicas. No obstante, de todos ellos la covelita es la más interesante desde un punto de vista estructural y estético (por su iridiscencia y tonos azules). Por lo tanto, se mencionan a continuación algunas de sus propiedades.
Masa molar
95,611 g/mol.
Densidad
4,76 g/mL.
Punto de fusión
500ºC; pero se descompone.
Solubilidad en agua
3,3·10-5 g/100 mL a 18ºC.
No sólo varía el tamaño de las partículas hasta alcanzar dimensiones nanométricas, sino que además sus morfologías pueden oscilar en sumos grados. Así, el sulfuro de cobre puede formar nanoesferas, varillas, platos, películas delgadas, jaulas, cables o tubos.
Estas partículas y sus atractivas morfologías adquieren aplicaciones individuales en distintos terrenos de la medicina.
Por ejemplo, las nanojaulas o esferas vacías pueden servir como transportadoras de fármacos dentro del organismo. Las nanoesferas se han utilizado, soportadas por electrodos de vidrio de carbono y nanotubos de carbono, para fungir como detectores de glucosa; así como también sus agregados son sensibles a las detecciones de biomoléculas como el ADN.
Los nanotubos de CuS superan a las nanoesferas en la detección de glucosa. Además de estas biomoléculas, se han diseñado inmunosensores a partir de películas delgadas de CuS y determinados soportes para la detección de patógenos.
Las nanocristales y agregados amorfos de CuS pueden inclusive ocasionar la apoptosis de células cancerígenas, sin causar daño en las células sanas.
En el subapartado anterior se dijo que sus nanopartículas han formado parte de biosensores y electrodos. Además de tales usos, también los científicos y técnicos han aprovechado sus propiedades para diseñar celdas solares, capacitores, baterías de litio, y catalizadores para reacciones orgánicas muy específicas; elementos indispensables en nanociencia.
También cabe mencionar que cuando están soportadas sobre carbono activado, el conjunto NpCuS-CA (CA: Carbón Activado, y Np: Nanopartículas) demostró servir como removedor de tintes nocivos para los humanos y, por lo tanto, funciona como un purificador de fuentes de agua absorbiendo moléculas indeseadas.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Wikipedia. (2019). Copper sulfide. Recuperado de: en.wikipedia.org
- Ivan Grozdanov y Metodija Najdoski. (1995). Optical and Electrical Properties of Copper Sulfide Films of Variable Composition. Journal of Solid State Chemistry Volume 114, Issue 2, 1 February 1995, Pages 469-475. doi.org/10.1006/jssc.1995.1070
- National Center for Biotechnology Information. (2019). Copper sulfide (CuS). PubChem Database. CID=14831. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Peter A. Ajibade y Nandipha L. Botha. (2017). Synthesis, Optical and Structural Properties
- of Copper Sulfide Nanocrystals from Single Molecule Precursors. Department of Chemistry, University of Fort Hare, Private Bag X1314, Alice 5700, South Africa. Nanomaterials, 7, 32.
- Collaboration: Authors and editors of the volumes III/17E-17F-41C (s.f.). Copper sulfides (Cu2S, Cu(2-x)S) crystal structure, lattice parameters. In: Madelung O., Rössler U., Schulz M. (eds) Non-Tetrahedrally Bonded Elements and Binary Compounds I. Landolt-Börnstein- Group III Condensed Matter (Numerical Data and Functional Relationships in Science and Technology), vol 41C. Springer, Berlin, Heidelberg.
- Momtazan, F., Vafaei, A., Ghaedi, M. et al. Korean J. Chem. Eng. (2018). Application of copper sulfide nanoparticles loaded activated carbon for simultaneous adsorption of ternary dyes: Response surface methodology. 35: 1108. doi.org/10.1007/s11814-018-0012-1
- Goel, S., Chen, F., & Cai, W. (2014). Synthesis and biomedical applications of copper sulfide nanoparticles: from sensors to theranostics. Small (Weinheim an der Bergstrasse, Germany), 10(4), 631–645. doi:10.1002/smll.201301174
