Oxígeno molecular: estructura, propiedades, usos
El oxígeno molecular o dioxígeno, también llamado oxígeno diatómico o gaseoso, es la forma elemental más común en la que se encuentra este elemento en el planeta Tierra. Su fórmula es O2, siendo por lo tanto una molécula diatómica y homonuclear, totalmente apolar.
El aire que respiramos se compone alrededor de 21% de oxígeno como moléculas O2. Mientras más ascendemos, disminuyen las concentraciones de oxígeno gaseoso, y aumenta la presencia del ozono, O3. Nuestro cuerpo aprovecha el O2 para oxigenar sus tejidos y desempeñar la respiración celular.

El O2 es el responsable asimismo de la existencia del fuego: sin él sería casi imposible de que hubiera incendios y combustiones. Esto se debe a que su principal propiedad es la de ser un poderoso agente oxidante, ganando electrones o reduciéndose en una molécula de agua, o en aniones de óxido, O2-.
El oxígeno molecular es esencial para infinidad de procesos aeróbicos, teniendo aplicaciones en la metalurgia, en la medicina y en el tratamiento de las aguas residuales. Este gas prácticamente es sinónimo de calor, respiración, oxidación y, por otra parte, de temperaturas heladas cuando se tiene en su estado líquido.
Índice del artículo
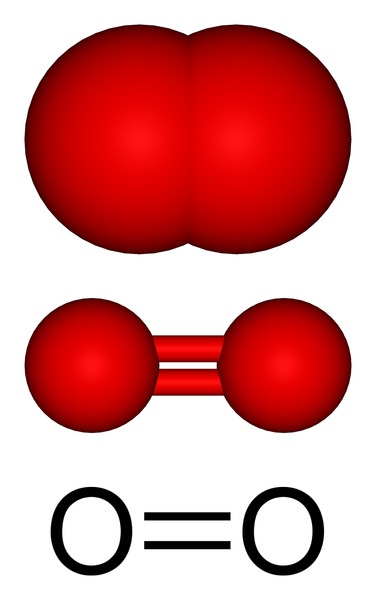
En la imagen superior tenemos la estructura molecular del oxígeno gaseoso representada con varios modelos. En los últimos dos se evidencian las características del enlace covalente que mantiene unidos los átomos de oxígeno: un enlace doble O=O, en el que cada átomo de oxígeno completa su octeto de valencia.
La molécula O2 es lineal, homonuclear y simétrica. Su doble enlace tiene una longitud de 121 pm. Esta corta distancia hace que se requiera cierta energía considerable (498 kJ/mol) para romper el enlace O=O, y que por ende sea una molécula relativamente estable.
Si no fuera así, el oxígeno de la atmósfera se hubiera degradado por completo con el paso del tiempo, o el aire se incendiaría de la nada.
El oxígeno molecular es un gas incoloro, insípido e inodoro, pero que al condensarse y cristalizarse adquiere tonalidades azuladas.
32 g/mol (valor redondeado)
-218 ºC
-183
El oxígeno molecular es poco soluble en agua, pero lo suficiente para sustentar la fauna marina. Si su solubilidad fuera mayor, sería menos probable morir de ahogamiento. Por otra parte, su solubilidad es mucho mayor en aceites y líquidos apolares, siendo capaz de oxidarlos lentamente y afectar así sus propiedades originales.
El oxígeno molecular es una sustancia que no puede ser del todo descrita mediante la teoría del enlace de valencia (TEV).
La configuración electrónica del oxígeno es la siguiente:
[He] 2s² 2p⁴
Tiene un par de electrones desapareados (O:). Cuando dos átomos de oxígeno se encuentran, se enlazan para formar un doble enlace O=O, completando ambos el octeto de valencia.
Por lo tanto, la molécula O2 debería ser diamagnética, con todos sus electrones apareados. Sin embargo, se trata de una molécula paramagnética, y esto se explica mediante el diagrama de sus orbitales moleculares:
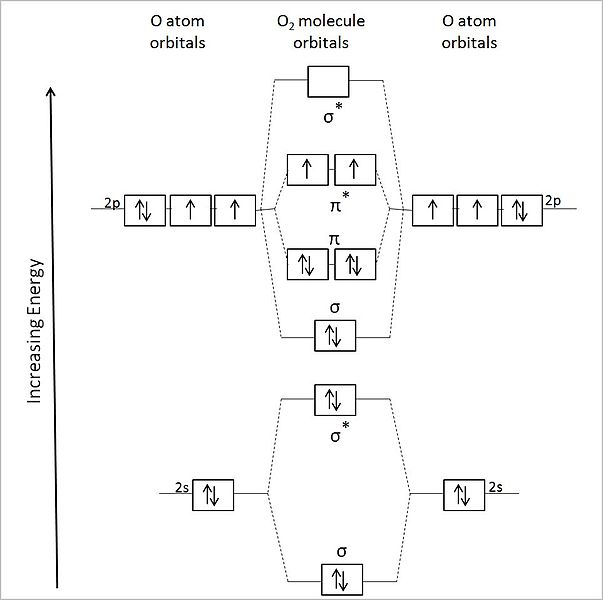
Es así pues que la teoría del orbital molecular (TOM) describe mejor al O2. Los dos electrones desapareados se ubican en los orbitales moleculares π*, de mayor energía, y dotan al oxígeno de su carácter paramagnético.
De hecho, este estado energético corresponde al oxígeno triplete, 3O2, el más predominante de todos. El otro estado energético del oxígeno, menos abundante en la Tierra, es el singlete, 1O2.
El oxígeno molecular es considerablemente estable siempre y cuando no esté en contacto con cualquier sustancia que sea susceptible a oxidarse, mucho menos si no hay ninguna fuente cercana de intenso calor, como una chispa. Esto se debe a que el O2 tiene una alta tendencia a reducirse, ganar electrones de otros átomos o moléculas.
Cuando se reduce, es capaz de establecer un amplio espectro de enlaces y formas. Si forma enlaces covalentes, lo hará con átomos menos electronegativo que él, incluyendo el hidrógeno, para originar agua, H-O-H. También podrá universe al carbono, para originar enlaces C-O y varios tipos de moléculas orgánicas oxigenadas (éteres, cetonas, aldehídos, etc.).
El O2 también puede ganar electrones para transformarse en los aniones peróxidos y superóxidos, O22- y O2–, respectivamente. Cuando se convierte en el peróxido dentro del organismo, se obtiene el peróxido de hidrógeno, H2O2, H-O-O-H, compuesto nocivo que es procesado por la acción de enzimas específicas (peroxidasas y catalasas).
Por otra parte, y no menos importante, el O2 reacciona con la materia inorgánica para convertirse en el anión óxido, O2-, componiendo una lista interminable de masas mineralógicas que engrosan la corteza y manto terrestres.

El oxígeno se utiliza para llevar a cabo la reacción de combustión, por la cual una sustancia se oxida exotérmicamente desprendiendo fuego. Este fuego y su temperatura varían dependiendo de la sustancia que está ardiendo. Así, puede obtenerse llamas muy calientes, como la del acetileno (arriba), con las cuales se sueldan metales y aleaciones.
De no ser por el oxígeno, los combustibles tampoco podrían arder y brindar toda su energía calórica, utilizada para despegar cohetes, o para poner en marcha los automóviles.
Gracias a este gas se sintetizan o producen industrialmente un sinfín de óxidos orgánicos e inorgánicos. Estas reacciones se basan en el poder oxidante del oxígeno molecular, siendo también uno de los reactivos más viable de la química verde para la obtención de productos farmacéuticos.
El oxígeno es vital para cubrir la demanda respiratoria en pacientes con estados graves de salud, en buzos cuando descienden a bajas profundidades, y en los escaladores de montañas, en cuyas altitudes la concentración de oxígeno se ve dramáticamente reducida.
Asimismo, el oxígeno “alimenta” las bacterias aeróbicas, las cuales ayudan a degradar residuos contaminantes de las aguas residuales, o ayuda a respirar a los peces, en cultivos acuosos para su protección o comercio.
- Shiver & Atkins. (2008). Química Inorgánica. (cuarta edición). Mc Graw Hill.
- Wikipedia. (2020). Allotropes of oxygen. Recuperado de: en.wikipedia.org
- Hone, C.A., Kappe, C.O. (2019). The Use of Molecular Oxygen for Liquid Phase Aerobic Oxidations in Continuous Flow. Top Curr Chem (Z)377, 2. doi.org/10.1007/s41061-018-0226-z
- Kevin Beck. (28 de enero de 2020). 10 Uses for Oxygen. Recuperado de: sciencing.com
- Cliffsnotes. (2020). Biochemistry I: The Chemistry of Molecular Oxygen. Recuperado de: cliffsnotes.com
- GZ Industrial Supplies. (2020). Industrial benefits of Oxygen gas. Recuperado de: gz-supplies.com
