Ciclopropano (C3H6): qué es, estructura, propiedades, usos, riesgos
¿Qué es el ciclopropano?
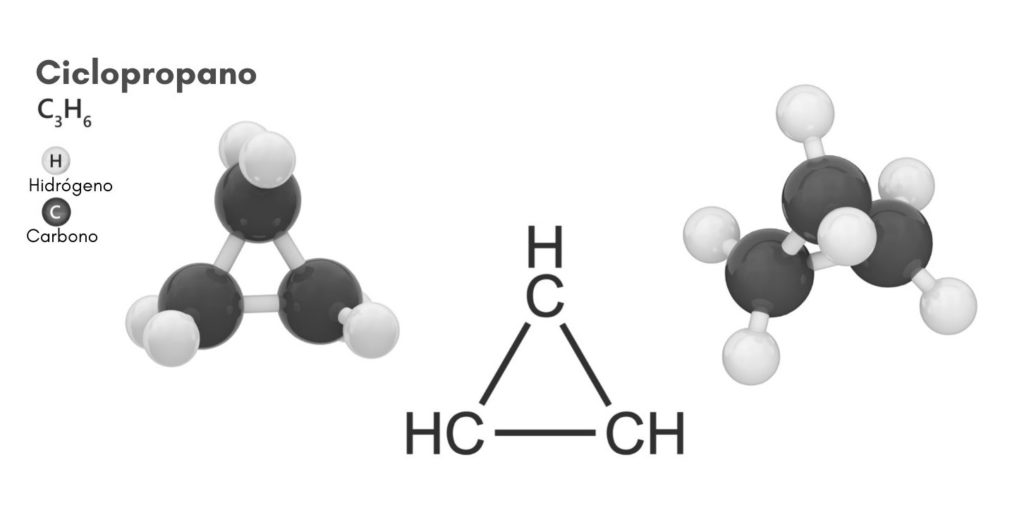
El ciclopropano es una molécula cíclica que posee la fórmula molecular C3H6, y que consiste en tres átomos de carbono unidos entre sí en forma de un anillo. En química existe una familia de hidrocarburos saturados que tienen un esqueleto formado por átomos de carbono unidos por enlaces simples en forma de anillo.
Esta familia consiste en un número variado de moléculas (las cuales se diferencian por la longitud de su cadena carbonada principal), y son conocidos por poseer puntos de fusión y ebullición más altos que aquellas de cadenas altas, además de una mayor reactividad que estas.
El ciclopropano fue descubierto en el año 1881 por un químico austriaco llamado August Freund, quien estaba decidido en saber cuál era el elemento tóxico en el etileno y quien llegó a pensar que era el mismo ciclopropano.
Aun así, no fue hasta la década de 1930 que se comenzó a producir a nivel industrial, cuando descubrieron sus usos como anestesia, debido a que antes de ese momento no le encontraban atractivo comercial.
Estructura química
El ciclopropano, de fórmula molecular C3H6, consiste en tres pequeños átomos de carbono que se unen en una configuración tal que se forma un anillo, quedando con una simetría molecular de D3h en cada carbono de la cadena.
La estructura de esta molécula requiere que los ángulos de enlace que se forman sean de unos 60º, mucho menores a los de 109,5º que se observan entre los átomos híbridos sp3, el cual es un ángulo más estable termodinámicamente.
Esto lleva a que el anillo sufra de una tensión estructural más significativa que otras estructuras de este tipo, además de una tensión torsional natural que posee por la conformación eclipsada de sus átomos de hidrógeno.
Por esta misma razón, los enlaces que se forman entre los átomos de carbono en esta molécula son considerablemente más débiles que en los alcanos comunes.
De manera peculiar y a diferencia de otros enlaces donde la cercanía entre dos moléculas simboliza mayor energía de enlace, los enlaces entre los carbonos de esta molécula tienen una particularidad de poseer una longitud menor a los otros alcanos (por su geometría), y a la vez son más débiles que las uniones entre aquellos.
Además, el ciclopropano posee la estabilidad por deslocalización cíclica de los seis electrones en los enlaces carbono-carbono, siendo ligeramente más inestable que el ciclobutano y considerablemente más que el ciclohexano.
Propiedades del ciclopropano
Punto de ebullición
En comparación con los otros cicloalcanos más comunes, el ciclopropano posee el menor punto de ebullición entre estos tipos de molécula, voltatilizándose a 33 grados bajo cero (ningún otro cicloalcano volatiliza en temperaturas menores a cero).
En cambio, en comparación con el propano lineal, el ciclopropano posee un punto de ebullición más alto: este volatiliza a 42 ºC bajo cero, ligeramente menor a la de su primo cicloalcano.
Punto de fusión
El punto de fusión del ciclopropano es menor que el de los demás cicloalcanos, fundiéndose a una temperatura de 128 ºC menor a cero. Aun así, no es el único cicloalcano que funde a temperatura menor a cero, pudiéndose observar este fenómeno también en el ciclobutano, ciclopentano y el cicloheptano.
De manera que, en el caso del propano lineal, este se funde a una temperatura menor de 187 ºC bajo cero.
Densidad
El ciclopropano posee la mayor densidad entre los cicloalcanos, siendo más de dos veces mayor al cicloalcano común más denso (1,879 g/l para el ciclopropano, superando al ciclodecano con 0,871).
También se observa una mayor densidad en el ciclopropano que en el propano lineal. La diferencia en puntos de ebullición y fusión entre los alcanos lineales y los cicloalcanos se debe a mayores fuerzas de London, las cuales aumentan por la forma de anillo que permite que exista mayor área de contacto entre átomos internos.
Reactividad
La reactividad de la molécula de ciclopropano se ve directamente afectada por la debilidad de sus enlaces, incrementándose considerablemente en comparación con otros cicloalcanos por efecto de la tensión que se ejerce en estas uniones.
Gracias a esto, el ciclopropano puede separarse de manera más sencilla, y puede llegar a comportarse como alqueno en determinadas reacciones. De hecho, la extrema reactividad de las mezclas de ciclopropano-oxígeno puede llegar a ser un peligro de explosión.
Usos/aplicaciones
El uso comercial del ciclopropano por excelencia es como agente anestésico, estudiándose esta propiedad por primera vez en el año 1929.
El ciclopropano es un agente anestésico potente de rápida acción, que no irrita las vías respiratorias ni presenta mal olor. Fue utilizado por varias décadas junto con el oxígeno para dormir a los pacientes durante intervenciones quirúrgicas, pero comenzaron a observarse efectos secundarios no deseados representados como “choque ciclopropano”.
Junto a los factores de costo y alta inflamabilidad, fue pasando por un proceso de descarte y reemplazo por otros agentes anestésicos más seguros.
A pesar de que siguió formando parte de los compuestos usados en la inducción de la anestesia, hoy en día no forma parte de los agentes utilizados en aplicaciones médicas.
Riesgos
– El ciclopropano es un gas altamente inflamable, el cual produce gases tóxicos al entrar en contacto con una llama. Además, puede llegar a reaccionar con agentes oxidantes como percloratos, peróxidos, permanganatos, nitratos y halógenos, causando incendios y/o explosiones.
– El ciclopropano en altos niveles puede causar dolores de cabeza, mareos, náuseas, pérdida de coordinación, sensación de desmayo y/o desvanecimiento.
– También puede generar irregularidades en el ritmo cardíaco o arritmia, dificultades para respirar, coma e incluso la muerte.
– El ciclopropano licuado puede llegar a causar congelación en la piel por su temperatura considerablemente menor a cero.
– Por ser un gas en condiciones ambientales, este compuesto puede entrar fácilmente al cuerpo por el aire, y además disminuye el nivel de oxígeno en el aire.
