Balance de materia: ecuación general, tipos y ejercicio
El balance de materiaes el conteo de los componentes que pertenecen a un sistema o proceso bajo estudio. Este balance puede aplicarse casi a cualquier tipo de sistema, ya que se asume que la suma de las masas de tales elementos debe permanecer constante a diferentes tiempos de mediciones.
Se puede entender por componente a canicas, bacterias, animales, maderos, ingredientes para una torta; y en el caso de la química, moléculas o iones, o más específicamente, compuestos o sustancias. Entonces, la masa total de las moléculas que entran a un sistema, con o sin reacción química, debe permanecer constante; siempre y cuando no haya pérdidas por fuga.

En la práctica se presenta innumerables problemas que pueden afectar el balance de materia, además de que debe tener en cuenta diversos fenómenos de la materia y el efecto de muchas variables (temperatura, presión, flujo, agitación, tamaño del reactor, etc.).
En el papel, sin embargo, los cálculos del balance de materia deben coincidir; esto es, la masa de los compuestos químicos no debe desaparecer en ningún momento. Hacer este balance es análogo a poner una pila de rocas en equilibrio. Si una de las masas se sale de lugar, todo se viene abajo; en este caso, significaría que los cálculos están mal hechos.
Índice del artículo
En todo sistema o proceso debe definirse primeramente cuáles son sus fronteras. A partir de ellas, se sabrá qué compuestos entran o salen. Es conveniente hacerlo en especial si hay múltiples unidades de proceso que considerar. Cuando se consideran todas las unidades o subsistemas, se habla entonces de un balance de materia general.
Este balance tiene una ecuación, la cual puede aplicarse a cualquier sistema que obedezca la ley de la conservación de la masa. La ecuación es la siguiente:
E + G – S – C = A
Donde E es la cantidad de materia que entra al sistema; G es lo que se genera si en el proceso ocurre una reacción química (como en un reactor); S es lo que sale del sistema; C es lo que se consume, nuevamente, si hay reacción; y por último, A es lo que se acumula.
Si en el sistema o proceso que se estudia no hay reacción química, G y C valen cero. Así, la ecuación queda como:
E – S = A
Si el sistema además se considera en estado estacionario, sin cambios apreciables en las variables o flujos de los componentes, se dice que nada se acumula en su interior. Por lo tanto, A vale cero, y la ecuación termina por simplificarse aún más:
E = S
Es decir, la cantidad de materia que entra es igual a la que sale. Nada puede perderse o desaparecer.
Por otro lado, si hay reacción química, pero el sistema está en estado estacionario, G y C tendrán valores y A seguirá siendo cero:
E + G – S – C = 0
E + G = S + C
Significando que en un reactor la masa de los reactivos que entran y de los productos que generan en él, es igual a la masa de los productos y reactivos que salen, y a de los reactivos consumidos.
Supóngase que se está estudiando el número de peces en un río, cuyas riberas vienen a representar la frontera del sistema. Se sabe que en promedio 568 peces entran por año, 424 nacen (generan), 353 mueren (consumen), y 236 emigran o salen.
Aplicando la ecuación general se tiene entonces:
568 + 424 – 353 – 236 = 403
Esto quiere decir que por año 403 peces se acumulan en el río; es decir, por año el río se enriquece más de peces. Si A tuviera un valor negativo, significaría que el número de peces está disminuyendo, quizás a impactos ambientales negativos.
De la ecuación general se puede pensar que hay cuatro ecuaciones para distintos tipos de procesos químicos. Sin embargo, el balance de materia se divide en dos tipos de acuerdo a otro criterio: el tiempo.
En el balance de materia diferencial se tiene la cantidad de los componentes dentro de un sistema a un tiempo o momento dados. Dichas cantidades másicas se expresan con unidades de tiempo, y por lo tanto, representan velocidades; por ejemplo, Kg/h, indicando cuántos kilómetros entran, salen, se acumulan, generan o consumen en una hora.
Para que haya flujos másicos (o volumétricos, con la densidad a la mano), el sistema generalmente debe ser abierto.
Cuando el sistema es cerrado, como sucede con las reacciones llevadas a cabo en reactores intermitentes (tipo batch), suele interesar más las masas de sus componentes antes y después del proceso; es decir, entre los tiempos t inicial y final.
Por lo tanto, se expresan las cantidades como meras masas y no velocidades. Este tipo de balance se hace mentalmente cuando se utiliza una licuadora: la masa de los ingredientes que entran debe ser igual a la que queda después de apagar el motor.
Se desea diluir un flujo de una solución de metanol al 25% en agua, con otra de una concentración de 10%, más diluida, de tal manera que se genere 100 Kg/h de una solución de metanol al 17%. ¿Qué cantidad de ambas soluciones de metanol, al 25 y 10%, deben entrar al sistema por hora para lograr esto? Asuma que el sistema está en estado estacionario
El siguiente diagrama ejemplifica el enunciado:
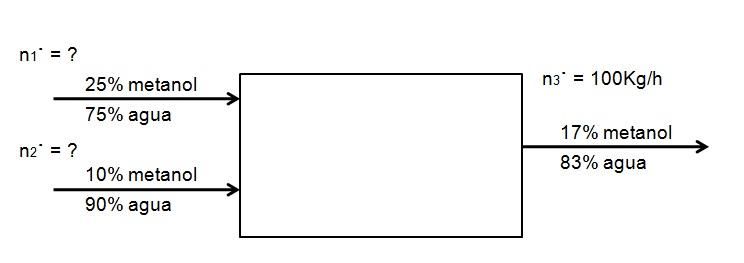
No hay reacción química, por lo que la cantidad de metanol que entra debe ser igual a la que sale:
EMetanol = SMetanol
0,25 n1· + 0,10 n2· = 0,17 n3·
Solo se conoce el valor de n3·. Lo demás son incógnitas. Para resolver esta ecuación de dos incógnitas se necesita de otro balance: el del agua. Haciendo entonces el mismo balance para el agua se tiene:
0,75 n1· + 0,90 n2· = 0,83 n3·
Se despeja para el agua el valor de n1· (puede también ser n2·):
n1· = (83 Kg/h – 0,90n2·)/ (0,75)
Sustituyendo entonces n1· en la ecuación de balance de materia para el metanol, y resolviendo para n2· se tiene:
0,25 [(83 Kg/h – 0,90n2·)/ (0,75)] + 0,10 n2· = 0,17 (100 Kg/h)
n2· = 53,33 Kg/h
Y para obtener n1· basta con restar:
n1· = (100- 53,33) Kg/h
= 46,67 Kg/h
Por lo tanto, por hora debe entrar al sistema 46,67 Kg de solución de metanol al 25%, y 53,33 Kg de la solución al 10%.
- Felder y Rousseau. (2000). Principios elementales de los procesos químicos. (Segunda edición.). Addison Wesley.
- Fernández Germán. (20 de octubre de 2012). Definición de balance de materia. Recuperado de: industriaquimica.net
- Balances de materia: procesos industriales I. [PDF]. Recuperado de: 3.fi.mdp.edu.ar
- UNT Facultad Regional La Plata. (s.f.). Balance de materia. [PDF]. Recuperado de: frlp.utn.edu.ar
- Gómez Claudia S. Quintero. (s.f.). Balances de materia. [PDF]. Recuperado de: webdelprofesor.ula.ve
