Ácido tartárico: estructura, propiedades, aplicaciones
¿Qué es el ácido tartárico?
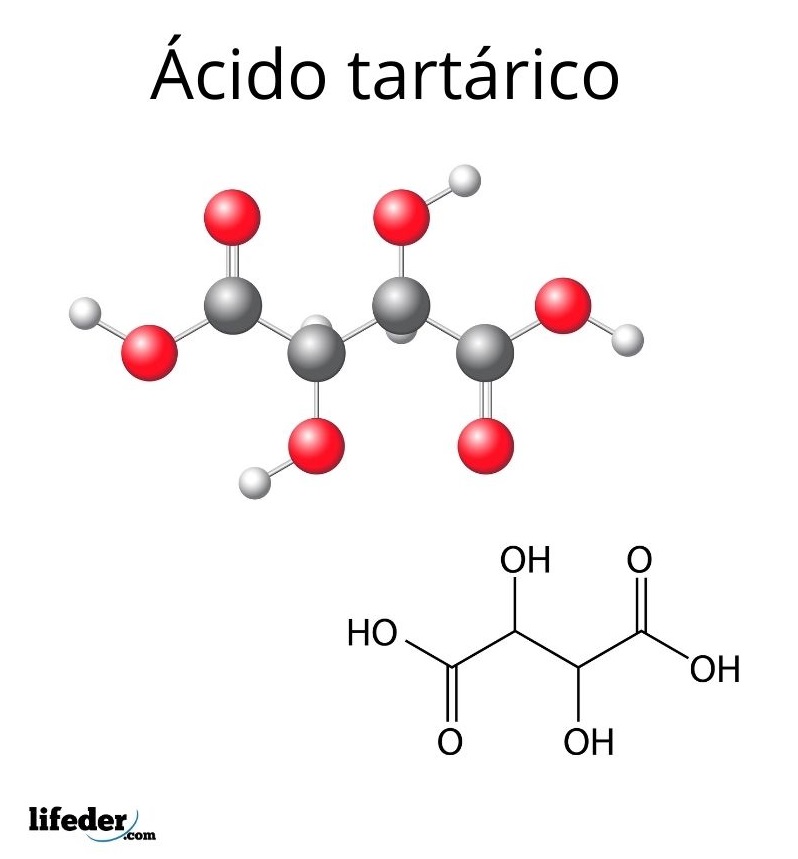
El ácido tartárico es un compuesto orgánico cuya fórmula molecular es COOH(CHOH)2COOH. Posee dos grupos carboxilos; es decir, puede liberar dos protones (H+). En otras palabras, es un ácido diprótico. Asimismo, puede clasificarse como un ácido aldárico (azúcar ácida) y un derivado del ácido succínico.
Su sal es conocida desde tiempos inmemoriales y constituye uno de los productos secundarios de la elaboración del vino. Esta cristaliza como un sedimento blanco bautizado como “diamantes de vino”, los cuales se acumulan en el corcho o en el fondo de las barricas y las botellas. Esta sal es el bitartrato de potasio (o tartrato ácido de potasio).
Las sales del ácido tartárico tienen en común la presencia de uno o dos cationes (Na+, K+. NH4+, Ca2+, etc.) debido a que, al liberar sus dos protones, permanece cargado negativamente con una carga de -1 (como ocurre con las sales de bitartrato) o de -2.
A su vez, este compuesto ha sido objeto de estudio y enseñanza de las teorías orgánicas relacionadas con la actividad óptica, más precisamente con la estereoquímica.
¿Dónde se encuentra el ácido tartárico?
El ácido tartárico es un componente de muchas plantas y alimentos, tales como los albaricoques, los aguacates, las manzanas, los tamarindos, las semillas de girasol y las uvas.
En el proceso de envejecimiento de los vinos este ácido —a temperaturas frías— se combina con el potasio para cristalizar como tartrato. En los vinos rojos es menor la concentración de dichos tartratos, mientras que en los vinos blancos son más abundantes.
Los tartratos son sales de cristales blancos, pero cuando ocluyen impurezas del entorno alcohólico, adquieren tonalidades rojizas o moradas.
Estructura del ácido tartárico
En la imagen superior está representada la estructura molecular del ácido tartárico. Los grupos carboxilos (–COOH) se ubican en los extremos laterales y están separados por una cadena corta de dos carbonos (C2 y C3).
A su vez, cada uno de estos carbonos está enlazado a un H (esfera blanca) y a un grupo OH. Esta estructura puede rotar el enlace C2–C3, generando de este modo varias conformaciones que estabilizan a la molécula.
Es decir, el enlace central de la molécula rota como un cilindro giratorio, alternando consecutivamente la disposición espacial de los grupos –COOH, H y OH (proyecciones Newman).
Por ejemplo, en la imagen los dos grupos OH apuntan en direcciones contrarias, lo que significa que están en posiciones anti entre sí. Lo mismo ocurre con los grupos –COOH.
Otra conformación posible es la de un par de grupos eclipsados, en la cual ambos grupos están orientados en la misma dirección. Estas conformaciones no jugarían un papel importante en la estructura del compuesto si todos los grupos de los carbonos C2 y C3 fueran iguales.
Como en este compuesto los cuatro grupos son diferentes (–COOH, OH, H, y el otro lado de la molécula), los carbonos son asimétricos (o quirales) y exhiben la famosa actividad óptica.
La forma en la que están dispuestos los grupos en los carbonos C2 y C3 del ácido tartárico determina algunas estructuras y propiedades distintas para el mismo compuesto; esto es, permite la existencia de estereoisómeros.
Aplicaciones del ácido tartárico
En la industria alimenticia
Se usa como estabilizador de eulsiones en panaderías. También se utiliza como ingrediente para la levadura, la mermelada, la gelatina y las bebidas gaseosas. Asimismo, cumple funciones como agente acidificante, leudante y secuestrador de iones.
El ácido tartárico se encuentra en estos alimentos: galletas dulces, caramelos, chocolates, líquidos gaseosos, productos de panificación y vinos.
En la elaboración de los vinos se utiliza para hacerlos más equilibrados, desde el punto de vista gustativo, al disminuir el pH de estos.
En la industria farmacéutica
Es usado en la creación de pastillas, antibióticos y píldoras efervescentes, así como en medicinas utilizadas en el tratamiento de cardiopatías.
En la industria química
Se usa en la fotografía, así como en la galvanotecnia y es un antioxidante ideal para las grasas industriales.
También se usa como secuestrador de iones metálicos. ¿Cómo? Rotando sus enlaces de tal manera que pueda ubicar los átomos de oxígeno del grupo carbonilo, ricos en electrones, en torno a estas especies cargadas positivamente.
En la industria de la construcción
Retarda el proceso del endurecimiento del yeso, el cemento y la escayola, haciendo más eficiente la manipulación de estos materiales.
Propiedades del ácido tartárico
Las aplicaciones más comunes del ácido tartárico son:
- El ácido tartárico es comercializado en forma de polvo cristalino o de cristales blancos ligeramente opacos. Tiene un sabor agradable, y esta propiedad es indicativa de un vino de buena calidad.
- Funde a 206 ºC y arde a 210 ºC. Es muy soluble en agua, alcoholes, soluciones básicas y bórax.
- Su densidad es de 1,79 g/mL a 18 ºC y presenta dos constantes de acidez: pKa1 y pKa2. Es decir, cada uno de los dos protones ácidos tiene su propia tendencia a liberarse en el medio acuoso.
- Como tiene grupos –COOH y OH, puede ser analizado por espectroscopia infrarrojo (IR) para sus determinaciones cualitativas y cuantitativas.
- Otras técnicas como la espectroscopia de masa, y la resonancia magnética nuclear, permiten realizar los análisis anteriores sobre este compuesto.
Estereoquímica
El ácido tartárico fue el primer compuesto orgánico al que se le desarrolló una resolución enantiomérica. ¿Qué quiere decir esto? Significa que sus estereoisómeros pudieron ser separados manualmente gracias al trabajo investigativo del bioquímico Louis Pasteur, en 1848.
¿Y cuáles son los estereoisómeros del ácido tartárico? Estos son: (R, R), (S, S) y (R, S). R y S son las configuraciones espaciales de los carbonos C2 y C3.
El ácido tartárico (R, R), el más “natural”, rota la luz polarizada hacia la derecha; el ácido tartárico (S, S) la rota hacia la izquierda, en sentido contrario a las agujas del reloj. Y por último, el ácido tartárico (R, S) no rota la luz polarizada, siendo ópticamente inactivo.
Louis Pasteur, con ayuda de un microscopio y unas pinzas, encontró y separó cristales de ácido tartárico que mostraban patrones “diestros” y “zurdos”, tales como en la imagen superior.
De esta manera, los cristales “diestros” son aquellos formados por el enantiómero (R, R), mientras que los cristales “zurdos” son los del enantiómero (S, S).
Sin embargo, los cristales del ácido tartárico (R, S) no se diferencian de los otros, ya que exhiben características diestras y zurdas al mismo tiempo; por lo tanto, no pudieron ser “resueltos”.
Referencias
- Wikipedia. (2018). Tartaric acid. Recuperado de en.wikipedia.org
- PubChem. (2018). Tartaric Acid. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Understanding wine tartrates. Recuperado de jordanwinery.com
- Acipedia. Tartaric Acid. Recuperado de acipedia.org
- Pochteca. Acido tartárico. Recuperado de pochteca.com.mx
- Dhaneshwar Singh et al. (2012). On the Origin of the Optical Inactivity of meso-Tartaric Acid. Department of Chemistry, Manipur University, Canchipur, Imphal, India. J. Chem. Pharm. Res., 4(2):1123-1129.
