Voltamperometría: qué es, cómo funciona, tipos, aplicaciones
¿Qué es la voltamperometría?
La voltamperometría es una técnica electroanalítica que determina información de una especie química o analito a partir de las corrientes eléctricas generadas por la variación de un potencial aplicado. Es decir, el potencial E (V) aplicado, y el tiempo (t), son las variables independientes; mientras que la corriente (A), la variable dependiente.
La especie química normalmente debe ser electroactiva. Esto significa que debe perder (oxidarse) o ganar (reducirse) electrones. Para que la reacción inicie, el electrodo de trabajo debe suministrar el potencial necesario determinado teóricamente por la ecuación de Nernst.
Este método es muy utilizado en química inorgánica, bioquímica y física, sobre todo para analizar los procesos de oxidación, reducción o adsorción, entre otros.
¿Cómo funciona la voltamperometría?
La voltamperometría se desarrolló gracias a la invención de la técnica de polarografía por el premio Nobel de química de 1922, Jaroslav Heyrovsky (1890-1967). En ella, el electrodo de la gota de mercurio (EGM) se renueva y polariza constantemente.
Las deficiencias analíticas de este método por aquel entonces fueron solventadas con el uso y diseño de otros microelectrodos. Estos varían enormemente de material, desde carbón, metales nobles, diamante y polímeros, hasta en su diseño, discos, cilindros, láminas; y además, en el modo en el que interactúan con la disolución: estacionario o rotatorio.
Todos estos pormenores tienen como finalidad favorecer la polarización del electrodo, lo cual ocasiona un decaimiento de la corriente registrada conocida como corriente límite (i1). Esta es proporcional a la concentración del analito, y la mitad de la potencia E (E1/2) para alcanzar la mitad de dicha corriente (i1/2) es característica de la especie.
Entonces, determinando los valores de E1/2 en la curva donde se grafica la corriente obtenida con la variación de E, llamada voltamperograma, puede identificarse la presencia de un analito. Es decir, cada analito, dadas las condiciones del experimento, tendrá su propio valor de E1/2.
Onda voltamperométrica
En voltamperometría se trabaja con muchas gráficas. La primera de ellas es la curva E vs. t, la cual permite tener un seguimiento de las diferencias de potencial aplicadas en función del tiempo.
Pero al mismo tiempo, el circuito eléctrico registra los valores de C producidos por el analito al perder o ganar electrones en las cercanías del electrodo.
Debido a que el electrodo se encuentra polarizado, menos analito puede difundirse desde el seno de la disolución hacia él. Por ejemplo, si el electrodo tiene carga positiva, la especie X– se sentirá atraída por este y se dirigirá hacia él por mera atracción electrostática.
Pero X– no está solo: hay otros iones presentes en su entorno. Algunos cationes M+ pueden entorpecer su camino hacia el electrodo encerrándolo en “racimos” de cargas positivas; y asimismo, aniones N– pueden colearse alrededor del electrodo e impedir que X– llegue hasta él.
La sumatoria de estos fenómenos físicos ocasiona que se pierda corriente, y esto se observa en la curva C vs. E y su forma parecida a la de una S, llamada forma sigmoide. Esta curva es conocida como onda voltamperométrica.
Instrumentación
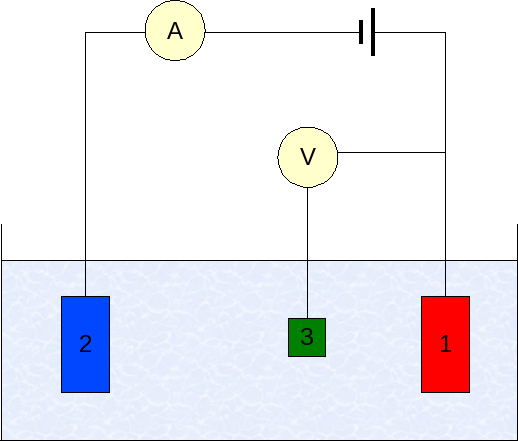
La instrumentación de la voltamperometría varía de acuerdo al analito, solvente, tipo de electrodo y aplicación. Pero, la gran mayoría de ellos se basan en un sistema conformado por tres electrodos: uno de trabajo (1), auxiliar (2) y el de referencia (3).
El principal electrodo de referencia utilizado es el electrodo de calomelanos (ECS). Este, en conjunto con el electrodo de trabajo, permite establecer una diferencia de potencial ΔE, ya que el potencial del electrodo de referencia permanece constante durante las mediciones.
Por otro lado, el electrodo auxiliar se encarga de controlar la carga que pasa al electrodo de trabajo, para así mantenerlo dentro de los valores de E aceptables. La variable independiente, la diferencia de potencial aplicado, es la obtenida por la sumatoria de los potenciales de los electrodos de trabajo y el de referencia.
Tipos de voltamperometría
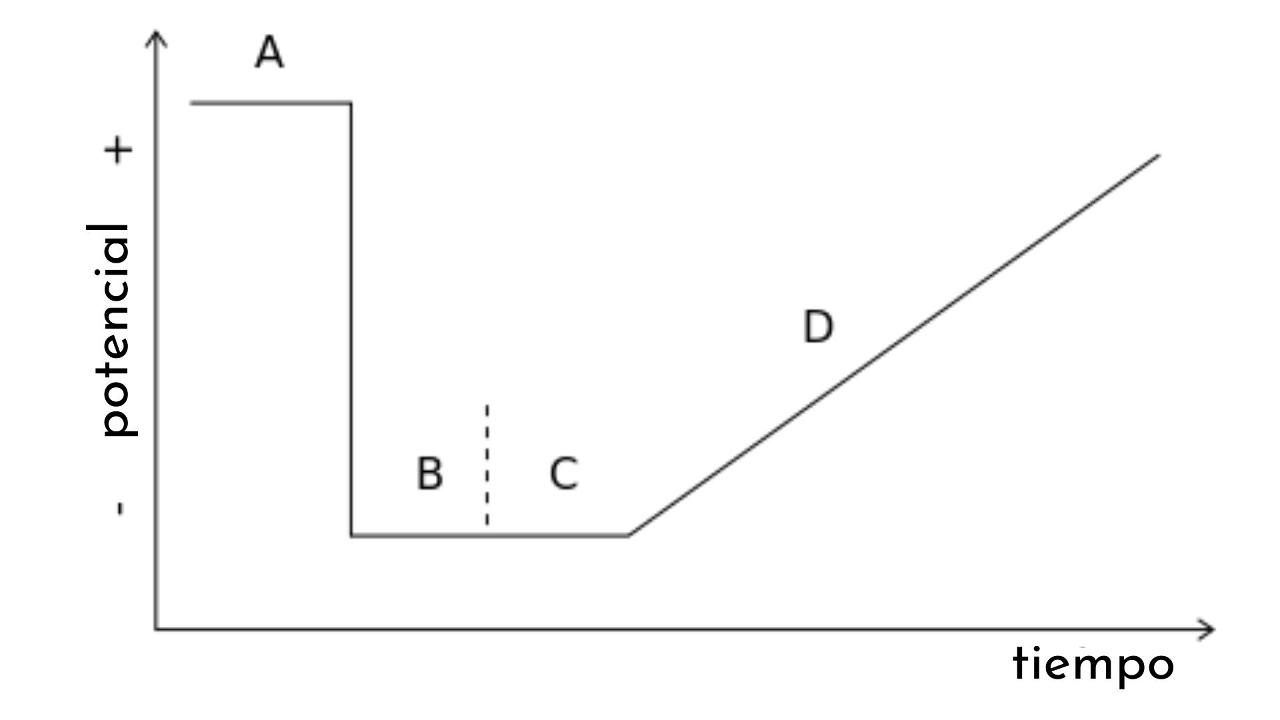
En la imagen del artículo se muestra una gráfica E vs. t, también llamada onda de potencial para una voltamperometría de barrido lineal.
Puede observarse que a medida que transcurre el tiempo, aumenta el potencial. A su vez, este barrido genera una curva respuesta, o voltamperograma C vs. E, cuya forma será sigmoidea. Llegará un punto en que sin importar cuánto aumente E, no habrá un incremento de la corriente.
A partir de esta gráfica pueden inferirse otros tipos de voltamperometría, modificando la onda de potencial E vs. t mediante súbitos pulsos de potencial siguiendo ciertos patrones. Cada patrón se asocia a un tipo de voltamperometría, y engloba su propia teoría y condiciones experimentales.
Voltamperometría de pulsos
En este tipo de voltamperometría se pueden analizar mezclas de dos o más analitos cuyos valores de E1/2 se encuentren muy cercanos entre sí.
Así, un analito con E1/2 de 0.04V puede identificarse en compañía de otro con un E1/2 de 0.05V. Mientras que en la voltamperometría de barrido lineal, la diferencia debe ser mayor de 0.2V.
Por lo tanto, hay mayor sensibilidad y límites de detección más bajos; es decir, pueden determinarse analitos a muy bajas concentraciones.
Las ondas de potenciales pueden tener patrones parecidos a escaleras, escaleras inclinadas, y triángulos. Este último corresponde a la voltamperometría cíclica (CV por sus siglas en inglés).
En la CV un potencial E se aplica en un sentido, positivo o negativo, y luego, a cierto valor de E en un tiempo t, vuelve a aplicarse el mismo potencial pero en sentido opuesto. Al estudiarse los voltamperogramas generados, los máximos revelan la presencia de intermediarios en una reacción química.
Voltamperometría de redisolución
Esta puede ser del tipo anódica o catódica. Consiste en la electrodeposición del analito sobre un electrodo de mercurio. Si el analito es un ion metálico (como el Cd2+), se formará una amalgama; y si es un anión (como el MoO42–), una sal de mercurio insoluble.
Después, se aplican pulsos de potenciales para determinar la concentración e identidad de la especie electrodepositada. Así, la amalgama se redisuelve, al igual que las sales de mercurio.
Aplicaciones de la voltamperometría
– La voltamperometría de redisolución anódica se utiliza para determinar la concentración de metales disueltos en fluido.
– Permite estudiar la cinética de los procesos redox o de adsorción, en especial, cuando los electrodos están modificados para detectar un analito en específico.
– Su base teórica ha servido para la fabricación de biosensores. Con estos, pueden determinarse la presencia y concentración de moléculas biológicas, proteínas, grasas, azúcares, etc.
– Finalmente, detecta la participación de intermediarios en los mecanismos de reacción.
Referencias
- González M. (2010). Voltamperometría. Recuperado de: quimica.laguia2000.com
- Química y Ciencia (2011). Voltamperometría. Recuperado de: laquimicaylaciencia.blogspot.com
- Quiroga A. (2017). Cyclic Voltammetry. Recuperado de: chem.libretexts.org
- Samuel P. Kounaves (s.f.). Voltammetric Techniques. [PDF]. Tufts University. Recuperado de: brown.edu
- Day R. & Underwood A. Química Analítica Cuantitativa (quinta ed.). PEARSON Prentice Hall.
