Regla de Markovnikov: qué es, ejemplos, ejercicios resueltos
¿Qué es la regla de Markovnikov?
La regla de Markovnikov es una regla empírica, formulada en 1869 por el químico ruso Vladimir Markovnikov, que se utiliza para predecir la regioselectividad de los productos de una adición electrofílica. Aun hoy sigue vigente, revelando su simplicidad el modo en cómo procede el mecanismo de varias reacciones orgánicas.
Esta regla aplica especialmente a los alquenos en sus reacciones de hidrohalogenación. Así, permite predecir cuáles serán los productos mayoritarios cuando los alquenos y alquinos reaccionan con HX (HF, HCl, HBr y HI).
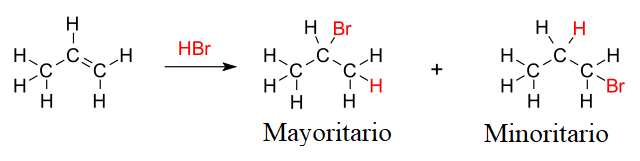
Supóngase por ejemplo la hidrobromación del propeno o propileno (imagen superior). La regla de Markovnikov predice que el producto mayoritario será aquel en el cual el átomo de bromo se enlaza al carbono del centro; mientras que en el producto menor, el bromo termina enlazado al carbono terminal del doble enlace.
Nótese además que el producto mayoritario tiene el átomo de hidrógeno enlazado al carbono terminal. Este último punto es el más fácil de memorizar: el hidrógeno del HX se va al carbono del doble enlace que posee más hidrógeno o enlaces C-H.
Principios de la regla de Markovnikov
Adición electrofílica
A los dobles enlaces de los alquenos o alquinos pueden adicionarse moléculas como HX. El HX tiene un átomo deficiente de electrones, que es el H, y un átomo rico en electrones, que es X.
Por lo tanto, HX puede representarse como Hδ+-Xδ-, siendo la región Hδ+ susceptible a recibir electrones del, en este caso, doble enlace de un alqueno, teniendo lugar el ataque electrofílico (ver imagen de abajo).
Estabilidad de los carbocationes
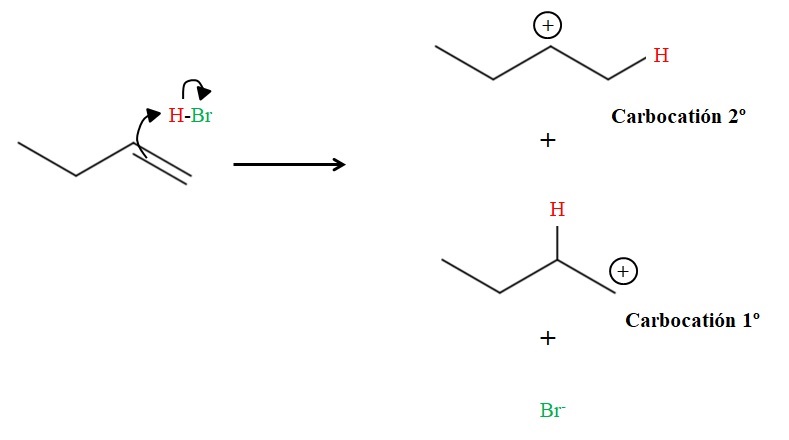
Como se aprecia arriba, el doble enlace del 1-buteno ataca al hidrógeno del HBr. Al hacerlo, los electrones del enlace H-Br se “abren” hacia el átomo de bromo, formándose un carbocatión y el anión Br–. Sin embargo, existe la posibilidad de formarse dos carbocationes: uno primario (1º) y el otro secundario (2º).
Cada carbocatión es un compuesto intermediario del cual derivará el producto final. Al haber dos carbocationes, tendremos entonces al final dos productos: 2-bromobutano y 1-bromobutano. El Br– actúa como un nucleófilo atacando a cualquiera de los dos carbocationes:
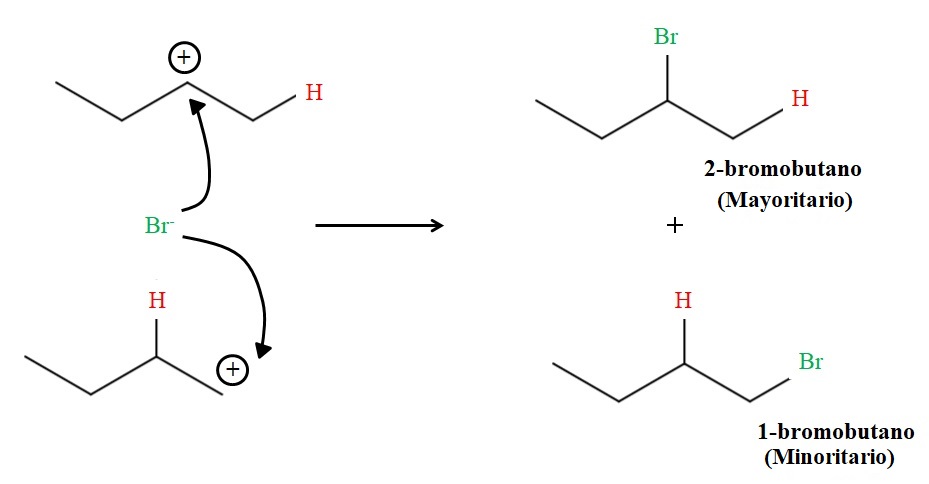
Pero la proporción de ambos productos no es del 50%; el 2-bromobutano se produce en mucha mayor cantidad que el 1-bromobutano.
La razón es que el carbocatión 2º es más estable que el carbocatión 1º, ya que su carga positiva se ve mejor estabilizada por los átomos de carbono adyacentes; mientras que en el carbocatión 1º, el átomo de hidrógeno no aporta casi nada de densidad electrónica a esa carga positiva (séase por inducción o hiperconjugación).
El rico se hace más rico
La regla de Markovnikov nació de las observaciones finales, y a partir de ellas pudo plantearse los mecanismos ilustrados arriba para poder explicarlas.
Sin necesidad de plasmar siempre estos mecanismos, o deducir la estabilidad de los carbocationes intermediarios, se recurre a la simple regla: en una adición electrofílica, los átomos de hidrógeno se dirigen hacia el carbono del doble con más átomos de hidrógeno. Así, el carbono más hidrogenado se vuelve todavía más hidrogenado.
Por otro lado, el átomo X, en este caso el Br, termina en el carbono del doble enlace que tiene más enlaces C-C, o que esté más sustituido por otros átomos que no sean hidrógeno. Debido a que en el 1-buteno su carbono terminal es =CH2, este es el que recibe el hidrógeno para transformarse en el grupo -CH3.
Ejemplos
Arriba se vio el caso de la regla de Markovnikov aplicada en la reacción de hidrobromación. También es válida para reacciones de hidrocloración, hidroiodación, hidroaminación e hidratación, ya sea para alquenos o alquinos.
En el siguiente apartado se verán algunos ejemplos adicionales a modo de ejercicios.
Ejercicios resueltos
Ejercicio 1
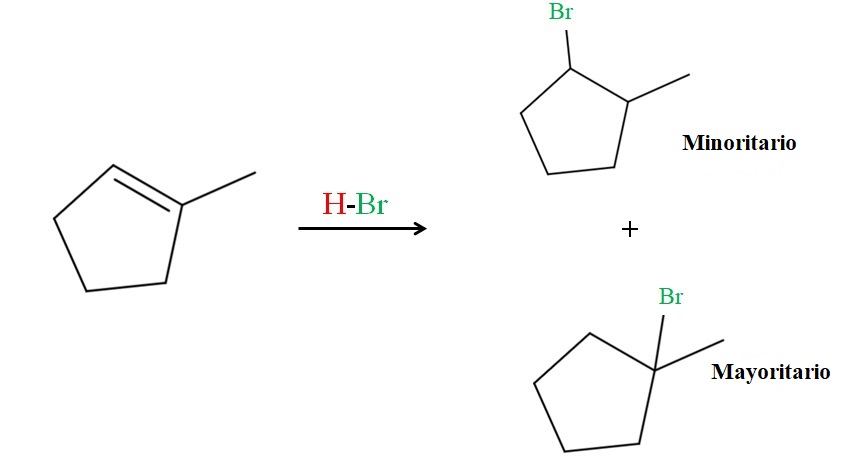
La regla de Markovnikov dice que el H del HBr para la reacción superior debe ir al carbono del doble enlace con más átomos de hidrógeno. En este caso, corresponde al carbono de arriba, ya que el carbono de la derecha, enlazado al CH3, ni siquiera posee átomos de hidrógeno.
Así, el hidrógeno del HBr se va hacia el carbono de arriba, mientras el Br termina enlazado al carbono de la derecha (producto mayoritario). Por otro lado, si el hidrógeno se enlaza en el carbono de la derecha, el Br se dirige al carbono de arriba (producto menoritario).
Nótese que el producto mayoritario consiste en un haluro 3º, más estable por definición y efectos de estabilización de las cargas positivas parciales; mientras el producto minoritario es un haluro 2º, menos estable.
Ambos productos, el mayoritario y el menoritario, se obtienen en la práctica, ya que por motivos estéricos y aleatorios siempre será probable que el hidrógeno vaya al carbono del doble enlace con menos hidrógeno. A este tipo de producto minoritario, en contra de la regla de Markovnikov, se le conoce como producto antimarkovnikov.
Ejercicio 2
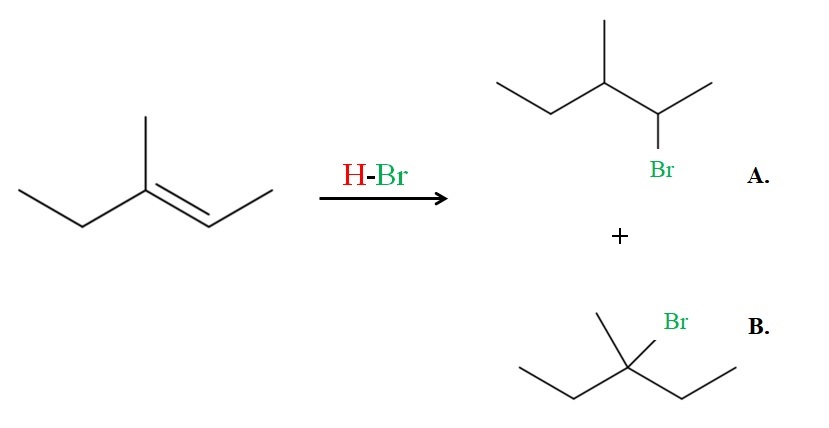
Ahora véase el ejemplo del 3-metil-2-penteno.
Si se observa, el carbono derecho del doble enlace tiene un H, mientras que el de la izquierda ninguno. Por lo tanto, el H del HBr irá hacia ese carbono, debiendo ir el Br al carbono del centro para originar el producto B. El producto B es el mayoritario, pues nuevamente se trata de un haluro 3º, siendo el producto A un haluro 2º.
Ejercicio 3
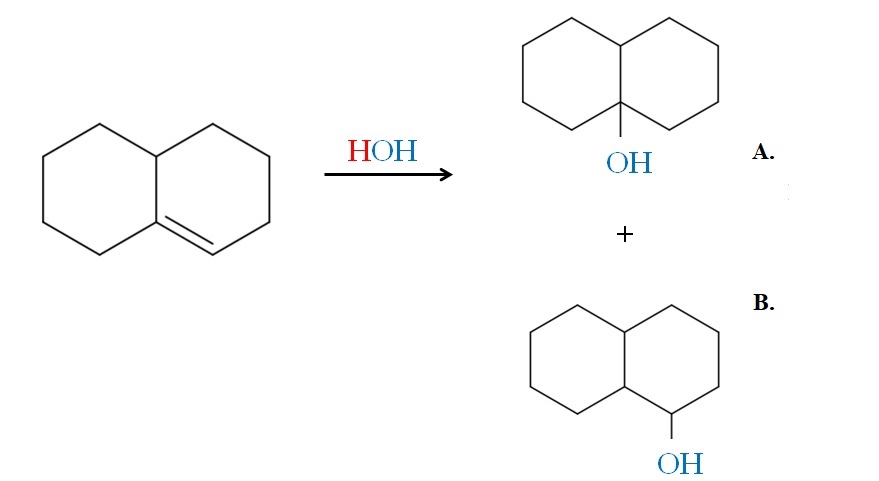
Los ejemplos anteriores hubieran generado los mismos productos si en lugar de HBr se usara HCl y HI. Lo mismo es igual que con el H2O en una reacción de hidratación catalizada por ácido y calor. El OH viene a reemplazar el átomo X del HX.
Por lo tanto, la regla de Markovnikov nos dice que en la adición electrofílica de arriba, el OH irá al carbono del doble enlace más sustituido, con menos hidrógenos.
Así, el producto A es el mayoritario, y el producto B el minoritario. Nótese otra vez que el producto A es un alcohol 3º, y el producto B un alcohol 2º.
Referencias
- Morrison, R. T. y Boyd, R, N. (1987). Química Orgánica. 5ta Edición. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. (10th edition.). Wiley Plus.
- Wikipedia. (2020). Markovnikov’s rule. Recuperado de: en.wikipedia.org
- Steven A. Hardinger. (2017). Illustrated Glossary of Organic Chemistry: Markovnikov’s rule. Recuperado de: chem.ucla.edu
- Gamini Gunawardena. (24 de agosto de 2020). Markovnikov’s rule. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
- The Editors of Encyclopaedia Britannica. (17 de septiembre de 2013). Markovnikov’s rule. Recuperado de: britannica.com
- Dr. S. Gevorg. (2020). Organic Chemistry: Markovnikov’s Rule with Practice Problems. Recuperado de: chemistrysteps.com
